Editor
ЛЕВОКЕТОКОНАЗОЛ
Назва англійською мовою: Levoketoconazole.
Група/призначення:
Інгібітор синтезу кортизолу. Механізм дії – пригнічення синтезу кортизолу та тестостерону.
Покази: лікування ендогенної гіперкортизолемії у дорослих з синдромом Кушинга, для яких хірургічне втручання не є варіантом або не було ефективним. Левокетоконазол не схвалений для лікування грибкових інфекцій, на відміну від кетоконазолу.
Синдром Кушинга – ендокринне захворювання, для якого характерними є хронічна гіперпродукція кортизолу, значні супутні захворювання, підвищений рівень смертності переважно через кардіоваскулярні ускладнення. Першою лінією лікування є хірургічне, а медикаментозне призначається у випадку протипоказань, затримки або неефективності хірургічного втручання.
Левокетоконазол є 2S,4R енантіомером, який походить з рацеміного кетоконазолу (однакова концентрація лівих і правих енантіомерів). Призначається перорально.
Альтернативні назви / синоніми: рекорлев.
Діюча речовина: левокетоназол.
Рекомендації при вагітності: не рекомендований.
Рекомендації при лактації: не рекомендований.
Прийом під час вагітності (короткий висновок):
Даних для оцінки впливу левокетоконазолу в період вагітності недостатньо. Активний синдром Кушинга в період вагітності пов’язаний з ризиком для матері та плода: гестаційний діабет, гестаційна гіпертензія, прееклампсія, смерть матері, самовільне переривання вагітності, внутрішньоутробна загибель плоду, передчасні пологи, загибель немовляти.
Жінку слід інформувати про потенційний ризик для плода.
Необхідно керуватись станом жінки і зважувати користь для матері та потенційний ризик для плода.
| ВАЖЛИВО: відомо про взаємодію левокетоконазолу з 778 лікарськими засобами, 3 станами/захворюваннями (гепатотоксичність, подовження інтервалу QT, гіпокаліемія/гіпомагніемія); щодо взаємодії з препаратами, то з 538 вона є вираженою, з 213 – помірною, з 27 – незначною. Перелік препаратів, які взаємодіють з левокетоконазолом доступний за посиланням: Levoketoconazole Interactions – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. |
Інформація щодо досліджень на тваринах:
Репродуктивні дослідження з використанням рацемічного кетоконазолу у мишей, щурів, кролів в період органогенезу продемонстрували ембріотоксичні ефекти на фоні доз на рівні максимальної рекомендованої для людини та нижчих. Крім того було відзначено дистоцію (важкі пологи) у мишей і щурів на фоні дози левокетоконазолу, нижчої від максимально рекомендоваої для людини.
Дослідження фертильності у собак продемонстрували залежний від дози прицільний вплив на тканини репродуктивних органів самців – порушення сперматогенезу та процесу дозрівання сперматозоїдів. Такі наслідки були зворотними – зникали після припинення лікування.
Інформація щодо впливу на плід:
Після введення рацемічного кетоконазолу 70% впливу спричиняв левокетоконазол – у тварин та людини.
Відсутня інформація про контрольовані дослідження у вагітних жінок.
Застосування препарату під час вигодовування:
Даних для оцінки ризику для немовляти на грудному вигодовуванні недостатньо. Відомо, що кетоконазол проникає до грудного молока. Доступна інформація про визначення концентрації левокетоконазолу в грудному молоці однієї жінки: присутній, в невеликій кількості, не відзначено негативного впливу на дитину.
| Не рекомендується годувати дитину під час лікування левокетоконазолом та ще один день після останньої дози |
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Левокетоконазол може знижувати рівень тестостерону і порушувати фертильність жінок і чоловіків.
Адаптовано за матеріалами:
- Levoketoconazole Uses, Side Effects & Warnings. Інформація з бази даних “Drugs.com”.
- McCartney NK, Baker DE. Levoketoconazole. Hospital Pharmacy. 2022;57(5):605-614. doi:10.1177/00185787221115368.
- Recorlev (Levoketoconazole Tablets): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі WebMD.
- RECORLEV – levoketoconazole tablet. Інформація з сайту “DAILYMED – US National Library of Medicine”.
- Ketoconazole. Інформація з бази даних “Drugs and Lactation Database (LactMed)”.
Адаптовано 29.05.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 29.05.2023 р.
ДИМЕТИЛФУМАРАТ
Назва англійською мовою: Dimethyl fumarate.
Група/призначення:
Імуномодулятор для лікування псоріазу та розсіяного склерозу.
Диметилфумарат метаболізується до монометилфумарату – активної речовини.
Альтернативні назви / синоніми: текфідера, фумадерм.
Діюча речовина: диметилфумарат.
Рекомендації при вагітності:
Дані від експериментальних тварин припускають ризик – не рекомендований.
Рекомендації при лактації: потенційно токсичний.
Прийом під час вагітності (короткий висновок):
Інформація про використання диметилфумарату у вагітних відсутня або дуже обмежена, що унеможливлює оцінку ризику для ембріону/плода. Якщо в період лікування діагностовано вагітність, то жінці рекомендовано зареєструватись в реєстрі від виробника.
|
РЕКОМЕНДОВАНО: 1. ПЕРЕД ПОЧАТКОМ ЛІКУВАННЯ ОТРИМАТИ НЕГАТИВНИЙ ТЕСТ НА ВАГІТНІСТЬ; 2. ВИКОРИСТОВУВАТИ НАДІЙНІ МЕТОДИ КОНТРАЦЕПЦІЇ ПІД ЧАС ЛІКУВАННЯ |
| ДОСТУПНИЙ РЕЄСТР ВАГІТНИХ, ЯКІ ОТРИМУВАЛИ ДИМЕТИЛФУМАРАТ/ТЕКФІДЕРУ В ПЕРІОД ВАГІТНОСТІ |
|
ЖІНКИ З РОЗСІЯНИМ СКЛЕРОЗОМ МОЖУТЬ ЗАРЕЄСТРУВАТИСЬ В ПОСТІЙНО ДІЮЧОМУ РЕЄСТРІ ВАГІТНИХ ВІД ТЕРАТОЛОГІЧНОЇ СЛУЖБИ OTIS/MotherToBABY |
| ВАЖЛИВО: відомо про взаємодію диметилфумарату з 359 лікарськими засобами, 5 станами/захворюваннями: інфекції (особливо герпевірусна), порушення функції печінки, лімфопенія, прогресуюча мультифокальна лейкоенцефалопатія (ПМЛ), порушення функції нирок; щодо взаємодії з препаратами, то з 42 вона є вираженою, з 310 – помірною, з 7 – незначною. Перелік препаратів, які взаємодіють з диметилфумаратом доступний за посиланням: Dimethyl fumarate Interactions – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. |
Інформація щодо досліджень на тваринах:
Дані від експериментальних тварин доступні в інструкції до препарату та на вебсайті FDA. Продемонстровано зменшення ваги плодів та затримку осифікації на фоні дози 250 мг/кг/день у щурів. Порівняння з дозами у людини проводилось, виходячи з монометилфумарату, який був присутнім у плазмі щурів у втричі вищій концентрації за AUC (AUC – фармакокінетичний параметр, який характеризує сумарну концентрацію лікарського препарату в плазмі крові протягом всього часу спостереження; це абревіатура від англ. Area Under the Curve (площа під кривою). Порушення постнатального розвитку потомства щурів виникало після застосування дози 25 мг/кг/день в період вагітності і лактації. Ця доза є нижчою від рекомендованої для людини. У кролів на фоні 5-кратної для людини дози відзначали ембріолетальність та материнську токсичність.
Диметилфумарат продемонстрував карциногенність у мишей і щурів. В одному дослідженні диметилфумарат та монометилфумарат не призводили до мутагенних наслідків. Обидва препарати проявили кластогенність в другому дослідженні, але диметилфумарат не продемонстрував такої властивості у третьому дослідженні.
Інформація щодо впливу на плід:
Невідомо, чи монометилфумарат проникає через плаценту у людини (диметилфумарат не визначається в плазмі). Молекулярна вага та низький рівень зв’язування з білками плазми монометилфумарату припускають плацентарний трансфер.
Огляд 2014 року наводить дані про 38 вагітностей з впливом диметилфумарату з наступними результатами: 3 вагітності продовжувались, 1 була втрачена з-під нагляду, 22 народжені живими дитини, 3 спонтанні аборти, 9 медичних абортів. Не повідомляється про токсичні наслідки.
Домаркетингові дослідження у вагітних з впливом диметилфумарату з приводу розсіяного склерозу продемонстрували наступне: 63 вагітні зазнали впливу у І триместрі з наступними результатами: 37 народжених живими, 4 спонтанні переривання, 14 медичних абортів, 5 незавершених вагітностей, 2 втрачені з-під нагляду. Результати 135 повідомлень про постмаркетингове використання диметилфумарату у І триместрі: 10 народжених живими 13 спонтанних абортів, 2 ектопічні вагітності, 5 медичних переривань, 103 незавершені вагітності, 2 втрачені з-під нагляду. В одному випадку медичного переривання вагітності діагностована вроджена вада (синдром каудальної регресії), яку не вважають спричиненою диметилфумаратом, оскільки жінка припинила лікування через 2 тижні після діагностування вагітності.
Дані проспективного реєстру з 345 жінок: 91% доношених немовлят, 82% з них відповідали середнім гестаційним показникам. Результати 351 вагітності: 277 народжених живими, 17 (5%) спонтанні аборти, 1 молярна вагітність, 1 ектопічна вагітність. Серед народжених живими діагностовано 8 вроджених вад (2,9%), 95 ДІ 1,3%-5,6%.
Повідомляється про 58 вагітностей з впливом диметилфумарату: 34 народжені живими, 9 спонтанних переривань, 15 медичних абортів. Серед народжених живими 1 дитина мала для гестаційного віку, а в 3 діагностовано вроджені вади.
Повідомляється про 27 випадків впливу препарату в І триместрі та 1 вроджену ваду (підковоподібну нирку).
Відсутня інформація про специфічні патерни вроджених вад.
Застосування препарату під час вигодовування:
Відсутня інформація про клінічне використання диметилфумарату в період грудного вигодовування. Відомо, що в грудному молоці виявляється невелика кількість монометилфумарату.
У двох жінок підрахували відносну дозу монометилфумарату, яку отримає немовля з грудним молоком – 0,019% та 0,007%.
| Більшість експертів вважають, що до отримання коректної інформації слід робити вибір між лікуванням матері та грудним вигодовуванням, керуючись станом матері. |
Якщо жінка годує немовля, то його слід моніторувати на предмет набирання ваги, оцінювати етапи розвитку, особливо це стосується новонароджених, які знаходяться на виключно грудному вигодовуванні. Деякі автори пропонують також моніторувати немовлят щодо почервоніння, блювоти, діареї.
Вплив на фертильність (чоловіків та жінок):
Диметилфумарат токсично впливає на яєчка у щурів, мишей, собак та несприятливо змінює показники сперми у щурів і собак на фоні доз, аналогічних використовуваним у людини. Щодо самок щурів, то описано порушення еструсу та загибель ембріонів на фоні дози, 5-кратної використовуваній у людині, виходячи з площі поверхні тіла.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Towers C, Forinash A. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. 12th edition, 2022, Wolters Kluwer. 1461 pages. ISBN: 978-1975-1-6237-5.
- Інформаційна система Центру репродуктивної токсикології “Reprotox”.
- Dimethyl fumarate Uses, Side Effects & Warnings. Інформація з бази даних “Drugs.com”.
- Інформаційна система “Teratogen Information System (TERIS)”.
- Tecfidera (Dimethyl Fumarate Delayed Release Capsules): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі WebMD.
- Dimethyl Fumarate. База даних “Drugs and Lactation Database (LactMed)”.
- Dimethyl fumarate Accord: Summary of Product Characteristics. Інформація з сайту Європейського агентства з лікарських засобів “European Medicines Agency”.
Адаптовано 01.05.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 29.07.2023 р.
ОЗАНІМОД
Назва англійською мовою: Ozanimod.
Група/призначення:
Імуномодулятор, модулятор сфінгозин 1-фосфат рецепторів (Sphingosine 1-Phosphate (S1P) Receptor).
Це селективний модулятор, який зв’язується з високою афінністю з рецепторами S1P типів 1 і 5. До прикладу, фінголімод з аналогічним механізмом дії має ширший спектр – модулює рецептори типів 1, 3, 4 та 5. Тому озанімод, як більш селективний препарат був створений для усуннення деяких побічних ефектів фінголімоду, включно з тахікардією.
Основний показ – лікування пацієнтів з релапсуючою формою розсіяного склерозу для зниження частоти клінічних загострень, а також виразкового коліту.
Це хворобо-модифікуюча терапія.
Альтернативні назви / синоніми: зепозія.
Діюча речовина: озанімод.
Рекомендації при вагітності: протипоказаний.
Рекомендації при лактації: протипоказаний.
Прийом під час вагітності (короткий висновок):
Озанімод впливає на сфінгозин 1-фосфат рецептори, які залучені до процесу ангіогенезу та формування судин в період ембріогенезу.
Дані від експериментальних тварин продемонстрували токсичний вплив на розвиток ембріону/плоду. Контрольованих досліджень у людини не проводилось.
КОРОТКІ ЗАУВАЖЕННЯ:
|
ПЛАНУВАННЯ ВАГІТНОСТІ: ПРИПИНИТИ ЛІКУВАННЯ ЗА ТРИ МІСЯЦІ ДО СПРОБИ ЗАВАГІТНІТИ |
|
РЕКОМЕНДОВАНО: 1. ПЕРЕД ПОЧАТКОМ ЛІКУВАННЯ ОТРИМАТИ НЕГАТИВНИЙ ТЕСТ НА ВАГІТНІСТЬ; 2. ВИКОРИСТОВУВАТИ НАДІЙНІ МЕТОДИ КОНТРАЦЕПЦІЇ ПІД ЧАС ЛІКУВАННЯ ТА ЩЕ, ПРИНАЙМНІ ТРИ МІСЯЦІ ПІСЛЯ ПРИПИНЕННЯ ЛІКУВАННЯ ОЗАНІМОД ПРОТИПОКАЗАНИЙ ЖІНКАМ РЕПРОДУКТИВНОГО ВІКУ, ЯКІ НЕ ВИКОРИСТОВУЮТЬ НАДІЙНУ КОНТРАЦЕПЦІЮ |
|
У ВИПАДКУ НАСТАННЯ ВАГІТНОСТІ НА ФОНІ ЛІКУВАННЯ ОЗАНІМОДОМ ЖІНКУ СЛІД ІНФОРМУВАТИ ПРО ПОТЕНЦІНИЙ РИЗИК ДЛЯ ПЛОДУ ТА ЗУПИНИТИ ПРИЙОМ ПРЕПАРАТУ |
| В ТОЙ ЖЕ ЧАС У ПАЦІЄНТІВ З РОЗСІЯНИМ СКЛЕРОЗОМ ПІСЛЯ ПРИПИНЕННЯ ЛІКУВАННЯ ІНШИМ ПРЕПАРАТОМ ЦІЄЇ ГРУПИ – ФІНГОЛІМОДОМ – НАСТУПАЄ НЕЗВОРОТНЕ ПОГІРШЕННЯ СТАНУ (в межах 11 тижнів), ЩО Є ОЧІКУВАНИМ І ДЛЯ ОЗАНІМОДУ |
| ДОСТУПНИЙ РЕЄСТР ВАГІТНИХ, ЯКІ ОТРИМУВАЛИ ОЗАНІМОД/ЗЕПОЗІЯ – ДЛЯ ЛІКАРІВ, ЯКІ СУПРОВОДЖУЮТЬ/МОНІТОРУЮТЬ ЦИХ ЖІНОК ТА ПАЦІЄНТОК (З РОЗСІЯНИМ СКЛЕРОЗОМ) |
|
ЖІНКИ З РОЗСІЯНИМ СКЛЕРОЗОМ МОЖУТЬ ЗАРЕЄСТРУВАТИСЬ В ПОСТІЙНО ДІЮЧОМУ РЕЄСТРІ ВАГІТНИХ ВІД ТЕРАТОЛОГІЧНОЇ СЛУЖБИ OTIS/MotherToBABY |
| ВАЖЛИВО: відомо про взаємодію озанімоду з 844 лікарськими засобами, 10 станами/захворюваннями (кардіоваскулярні (виражена взаємодія: протипоказаний пацієнтам з анамнезом інфаркту, ішемії, нестабільної стенокардії, серцевої недостатності тощо); ризик серцево-судинних ускладнень; гіпертонія; порушення функції печінки; інфекції (препарат підвищує ризик інфікування); макулярний набряк; порушення дихальної функції; енцефалопатія; вакцинація (при необхідності введення живих вакцин робити це за місяць до призначення препарату; пацієнтам з відсутністю антитіл до вірусу varicella zoster рекомендована вакцинація перед стартом лікування озанімодом); погіршення стану пацієнтів з розсіяним склерозом після відміни препарату); щодо взаємодії з препаратами, то з 435 вона є вираженою, з 390 – помірною, з 16 – незначною. Перелік препаратів, які взаємодіють з озанімодом доступний за посиланням: Ozanimod: Uses, Dosage, Side Effects & Warnings – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. |
Інформація щодо досліджень на тваринах:
Дослідження у вагітних тварин продемонстрували несприятливий вплив на розвиток, включно з ембріолетальністю, підвищенням частоти мальформацій (кровоносних судин, неправильне розміщення яєчок та хребців, генералізований набряк (анасарка) та нейроповедінкових відхилень – за відсутності токсичного впливу на материнський організм.
Дослідження у мишей тривалістю до 4 тижнів, щурів – до 26 тижнів та мавп – до 39 тижнів продемонстрували, що озанімод значно впливає на лімфатичну систему (лімфопенія, атрофія, зниження відповіді антитіл), призводить до збільшення ваги легень та частоти виникнення мононуклеарних альвеолярних інфільтратів, що узгоджується з основною активністю щодо рецепторів S1P1.
Призначення озанімоду вагітним щурам переорально в період органогенезу в дозах 0, 0,2, 1 або 5 мг/кг/день призводило до вираженого підвищення частоти загибелі ембріонів/плодів, скелетних варіацій (аномальна/затримана осифікація), зниження ваги плодів – на фоні найвищих тестованих доз – без ознак токсичного впливу на матерів. На фоні дози 1 мг/кг/день, яка не викликала несприятливих ефектів, AUC в плазмі для озанімоду приблизно у 60 разів перевищував показник у людини на фоні максимальної рекомендованої дози 0,92 мг/день (AUC – фармакокінетичний параметр, який характеризує сумарну концентрацію лікарського препарату в плазмі крові протягом всього часу спостереження; це абревіатура від англ. Area Under the Curve (площа під кривою). AUC плазми для основних метаболітів озанімоду у людини (CC112273 і CC1084037) були аналогічними або нижчими відповідно за показники у людини на фоні максимальної рекомендованої дози.
Призначення озанімоду вагітним кролям перорально в період органогенезу спричиняло суттєве зростання смертності ембріонів/плодів на фоні найвищих тестованих доз та підвищення частоти мальформацій у плодів (кровоносних судин) і скелетних варіацій на фоні середніх і високих доз – також без ознак материнської токсичності. У кролів доза, яка не призводила до несприятливих наслідків для плодів становила 0,2 мг/кг/день, на її фоні AUC плазми приблизно вдвічі перевищувала аналогічний показник у людини у випадку використання максимальної рекомендованої дози; показник AUC для основних метаболітів у людини (CC112273 і CC1084037) був нижчим від отримуваного в людини на фоні максимальної рекомендованої дози.
Призначення озанімоду в пероральних дозах 0, 0,2, 0,7 або 2 ,0 мг/кг/день самкам щурів протягом періоду вагітності та лактації призводило до стійкого зниження ваги тіла, довготривалого впливу на репродукцію (пролонгація еструсу) та нейроповедінкових змін у потомства (підвищення моторної активності) на фоні найвищих тестованих доз, які не асоціювались з материнською токсичністю. На фоні дози, яка не призводила до негативних наслідків в пре- та постнатальному періодах (0,7 мг/кг/день) показник AUC для озанімоду в плазмі в 30 разів перевищував аналогічний у людини на фоні максимальної рекомендованої дози, а для метаболітів (CC112273 і CC1084037) був нижчим за показник у людини.
Інформація щодо впливу на плід:
Озанімод інтенсивно метаболізується до кількох активних метаболітів, серед яких є два основні -CC112273 і CC1084037, які мають аналогічну активність та селективність до S1P1 та S1P5 рецепторів, як і основна сполука.
Максимальна концентрація в плазмі та AUC для озанімоду, CC112273 та CC1084037 наростають пропорційно зі збільшенням дози озанімоду від 0,46 мг до 0,92 мг (0,5 або 1 рекомендована доза). Після багаторазового призначення 94% циркулюючих активних сполук розподіляються наступним чином: озанімод – 6%, CC112273 – 73%, CC1084037 – 15%.
Максимальна концентрація озанімоду досягається приблизно через 6-8 годин після введення, CC112273 – через 10 годин.
Рівень зв’язування з білками плазми озанімоду 98,2%, CC112273 99,8%, CC1084037 99,3%.
Виведення: період напіввиведення озанімоду з плазми становить приблизно 21 годину, CC112273 – 11 днів.
Застосування препарату під час вигодовування:
Хоча озанімод та його активні метаболіти щільно зв’язуються з білками плазми і екскреція до грудного молока у великій кількості є малоймовірною, препарат є потенційно токсичним для немовляти на грудному вигодовуванні. Досвід застосування в період лактації відсутній, але подібний препарат фінголімод експертами вважається протипоказаним в період грудного вигодовування, особливо недоношених немовлят. Однак, виробник не вказує таких рекомендацій.
| Більшість експертів вважають озанімод протипоказаним в період грудного вигодовування |
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Ozanimod: Uses, Dosage, Side Effects & Warnings – Drugs.com. Інформація з бази даних “Drugs.com”.
- Ozanimod. Інформація з сайту “Cleveland Clinic”.
- Інформаційна система “Teratogen Information System (TERIS)”.
- Zeposia (Ozanimod Capsules): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі WebMD.
- Ozanimod – Drugs and Lactation Database. База даних “Drugs and Lactation Database (LactMed)”.
- Zeposia: Summary of Product Characteristics. Інформація з сайту Європейського агентства з лікарських засобів “European Medicines Agency”.
- What You Should Know About Taking ozanimod oral when pregnant, nursing, or administering to children or adults over 60. Інформація з сайту WebMD.
- DailyMed – ZEPOSIA- ozanimod hydrochloride capsule ZEPOSIA 7-DAY STARTER PACK- ozanimod hydrochloride kit ZEPOSIA STARTER KIT- ozanimod hydrochloride kit. Інформація з сайту “DAILYMED – US National Library of Medicine”.
Адаптовано 24.04.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 24.04.2023 р.
ГЕМОГЛОБІНОПАТІЇ ТА ВАГІТНІСТЬ
Назва англійською мовою:
Maternal Hemoglobinopathies and Pregnancy.
Альтернативні назви / синоніми: серповидноклітинна анемія, серповинноклітинна хвороба, серповидноподібна анемія, таласемія, серповидноклітинна анемія та вагітність, таласемія та вагітність, гемоглобінопатія.
Нормальні еритроцити дорослого містять три типи гемоглобіну (Hb), основним з яких є гемоглобін А. Hb A складається з 4 основних ланцюгів глобіну: два бета і два альфа ланцюги (β2α2). Два ланцюги β-глобіну кодуються 2 генами (по одному на кожний), а два ланцюги α-глобіну – 4 (по 2 на кожний). Гени всіх 4 ланцюгів розміщені на 11-й і 16-й хромосомах. Інші два види гемоглобіну містять незначні фракції – фетальний гемоглобін (HbF) і гемоглобін А2 (HbA2). Перехід від фетального гемоглобіну (HbF) до гемоглобіну дорослого (HbA) відбувається приблизно через 3–6 місяців після народження.
Термін гемоглобінопатії охоплює аномалії всіх генів глобіну, які призводять до утворення структурно аномального гемоглобіну (серповидноклітинна анемія) або незбалансованої продукції генів глобіну (таласемія). Це спадкові захворювання, на які страждає 7% населення світу і які успадковуються за аутосомно-рецесивним типом успадкування: батьки носії, ризик народження хворої дитини складає 25% при кожній вагітності; якщо в одного з батьків є гемоглобінопатія, а інший не має мутації гену, то всі діти цих батьків будуть носіями; якщо в одного з батьків є гемоглобінопатія, а другий носій, то ризик для потомства становить 50%. Причина захворювання – точкова мутація гену глобіну або делеція гену. Наявність мутації порушує здатність гемоглобіну переносити кисень. Важкі форми гемоглобінопатій пов’язані зі значним зниженням здатності переносити кисень і їх перебіг погіршується в період вагітності.
| ВАГІТНІСТЬ – ВИРІШЕННЯ ДВОХ ПИТАНЬ: |
| 1. Скринінг плодів на предмет гемоглобінопатії |
| 2. Якщо у вагітної серповидноклітинна анемія або велика таласемія, то сама вагітність може погіршувати клінічний перебіг |
| Пренатальний скринінг та контроль можливих ускладнень слід обговорити в ході консультування в період планування вагітності |
| ВАЖЛИВО: ОБОВ’ЯЗКОВЕ планування вагітності як у випадку спонтанної вагітності, так і у випадку застосування допоміжних репродуктивних технологій – ДЛЯ ЗНИЖЕННЯ РИЗИКУ ДЛЯ МАТЕРІ І ДИТИНИ |
| ПАЦІЄНТКИ ЗНАХОДЯТЬСЯ ПІД НАГЛЯДОМ МУЛЬТИДИСЦИПЛІНАРНОЇ КОМАНДИ ФАХІВЦІВ: гематолог, кардіолог, ендокринолог, гінеколог – під керівництвом фахівця з відповідної гемоглобінопатії, при потребі – психолог |
| ФОЛІЄВА КИСЛОТА ДЛЯ ПОПЕРЕДЖЕННЯ, ПЕРШ ЗА ВСЕ, ДЕФЕКТІВ НЕРВОВОЇ ТРУБКИ У ПЛОДІВ, А ТАКОЖ ЗМЕНШЕННЯ ВАЖКОСТІ ГЕМОЛІТИЧНОЇ АНЕМІЇ – в дозі 5 мг/добу ПЕРЕД ТА ПІД ЧАС ВАГІТНОСТІ |
ТАЛАСЕМІЯ (Thalassemia)
Генні мутації, які призводять до таласемії, виникли і поширились в популяціях як частковий захист від малярії.
| ТИПИ ТАЛАСЕМІЙ | |
| Альфа-таласемія (4 гени) | Бета-таласемія (2 гени) |
| Мутація або відсутній 1 альфа-ген – не має клінічних проявів (alpha thalassemia minima) | Бета-таласемія
Мутація або відсутній 1 бета-ген – м’яка клініка – це бета таласемія мала (beta thalassemia minor) |
| Мутація або відсітні 2 альфа-гени – м’яка симптоматика (alpha thalassemia minor) | |
| Мутація або відсутні 3 альфа-гени – помірна або важка симптоматика, інша назва Hemoglobin H disease | |
| Жінки з α та β малими формами та з незалежною від трансфузій HbH хворобою, зазвичай можуть моніторуватись як нормальні вагітності. Проте нормальні фізіологічні зміни, властиві вагітності, можуть погіршувати анемію та підвищувати ризик залізодефіцитної анемії. Якщо рівень феритину менший за 30 нг/мл слід призначати пероральні добавки заліза. | |
| Мутація або відсутні 4 альфа-гени – летальний стан, якщо дитина виживає, то потребує систематичної пожиттєвої гемотрансфузії (hydrops fetalis with Hemoglobin Barts) | Мутація або відсутні 2 бета-гени – симптоми від помірних до виражених – таласемія проміжна (thalassemia intermedia). Варіант з важким перебігом – це велика бета-таласемія або анемія Кулі (beta thalassemia major or Cooley’s anemia). |
| Жінки з β-таласемією великою та із залежною від трансфузій середньою формами вимагають в період вагітності супроводу мультидисциплінарної команди. | |
| СИМПТОМИ ТАЛАСЕМІЇ | |
| ПОМІРНО ВИРАЖЕНІ | ВАЖКІ |
|
ВАЖКІ – ДО ПОМІРНО ВИРАЖЕНИХ СИМПТОМІВ ДОДАЮТЬСЯ:
|
НЕПРАВИЛЬНА СТРУКТУРА КІСТОК ОБЛИЧЧЯ – ХАРАКТЕРНИЙ ФЕНОТИП:
|
|
| Ці фаціальні зміни можуть спричинити труднощі в мовленні, ковтанні, жуванні. ПОЧАТОК ТРАНСФУЗІЙ В РАННЬОМУ ВІЦІ МОЖЕ ПОПЕРЕДИТИ ФОРМУВАННЯ ТАКИХ ФАЦІАЛЬНИХ ОСОБЛИВОСТЕЙ! |
|
| ОБСТЕЖЕННЯ ЖІНОК З ТАЛАСЕМІЄЮ ПЕРЕД ВАГІТНІСТЮ (адаптовано з Origa R, Comitini F. Pregnancy in Thalassemia. Mediterr J Hematol Infect Dis. 2019 Mar 1;11(1):e2019019. doi: 10.4084/MJHID.2019.019. PMID: 30858957; PMCID: PMC6402552). |
|
| Обстеження партнера |
|
| Фертильність |
|
| ПОРУШЕННЯ ФЕРТИЛЬНОСТІ ВНАСЛІДОК ГІПОГОНАДОТРОПНОГО ГІПОГОНАДИЗМУ, СПРИЧИНЕНОГО ГЕМОСИДЕРОЗОМ ГІПОФІЗУ | |
| Перевантаження залізом |
|
|
ПІД ЧАС ВАГІТНОСТІ ЗРОСТАЄ РИЗИК ПЕРЕВАНТАЖЕННЯ ЗАЛІЗОМ. СЛІД ПРОЙТИ ЗАЗНАЧЕНІ ВИЩЕ ОБСТЕЖЕННЯ. У ВИПАДКУ ВИРАЖЕНОГО СИДЕРОЗУ РЕКОМЕНДОВАНО ВІДТЕРМІНУВАТИ НАСТАННЯ ВАГІТНОСТІ ТА ІНТЕНСИФІКУВАТИ ХЕЛАТНУ ТЕРАПІЮ. |
|
| Функція серцево-судинної системи |
|
| КІЛЬКА ФАКТОРІВ МОЖУТЬ ЗАГРОЖУВАТИ РОБОТІ СЕРЦЯ У ВАГІТНИХ: ЗБІЛЬШЕННЯ ОБ’ЄМУ КРОВІ, ЗМІНИ КРОВ’ЯНОГО ТИСКУ, РИТМУ, ВИКИДУ, ПРИПИНЕННЯ ХЕЛАТНОЇ ТЕРАПІЇ). КАРДІАЛЬНІ УСКЛАДНЕННЯ ЗАЛИШАЮТЬСЯ ОСНОВНОЮ ПРИЧИНОЮ СМЕРТІ ПАЦІЄНТІВ З ТАЛАСЕМІЄЮ | |
| Функція печінки |
|
| Функція ендокринної системи |
|
|
ВИЩИЙ РИЗИК ГЕСТАЦІЙНОГО ДІАБЕТУ ЧЕРЕЗ НАЯВНУ ІНСУЛІНОРЕЗИСТЕНТНІСТЬ ВНАСЛІДОК ПЕРЕВАНТАЖЕННЯ ЗАЛІЗОМ ПІДШЛУНКОВОЇ ЗАЛОЗИ. РЕКОМЕНДОВАНО СКРИНІНГ НА ГЕСТАЦІЙНИЙ ДІАБЕТ У ТЕРМІНІ 16 ТИЖНІВ ТА 28 ТИЖНІВ (якщо у 16 тижнів не було відхилень). |
|
| Інфекції |
|
| Тромофілія |
|
| Інше |
|
* SQUID-сенсорні магнітометричні системи (SQUID — Superconducting Quantum Interference Device)
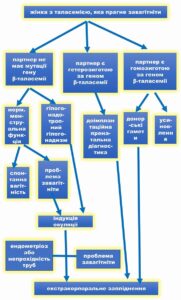
ВАРІАНТИ ВИРІШЕННЯ РЕПРОДУКТИВНИХ ПИТАНЬ ЖІНОК З ТАЛАСЕМІЄЮ, ЯКІ ПРАГНУТЬ ЗАВАГІТНІТИ (діаграма адаптована з Origa R, Comitini F. Pregnancy in Thalassemia. Mediterr J Hematol Infect Dis. 2019 Mar 1;11(1):e2019019. doi: 10.4084/MJHID.2019.019. PMID: 30858957; PMCID: PMC6402552).
ЗАУВАЖЕННЯ: вибір варіанту є суто особистим і залежить від етичних, етнічних, релігійних, культурних, фінансових факторів.
Така діаграма підходить також і для інших захворювань з аутосомно–рецесивним типом успадкування, включно з серповидноклітинною анемією, описаною нижче.
Ускладнення вагітності.
- Проміжна таласемія:
Згідно з даними більшості досліджень 60-80% жінок з проміжною таласемією потребують трансфузії в період вагітності, хоча з них 30% до того такої потреби не мали. Однак, жінки з проміжною таласемією, яким раніше не проводили гемотрансфузій або які отримували мінімальну кількість крові мають ризик важкої алоімунної анемії.
- Hemoglobin H disease.
Можливий розвиток водянки плода. Результати досліджень в Таїланді: 3,8% водянки плода були спричинені саме цим станом; також зафіксовано особливо низьку вагу при народженні; порівняння 120 жінок з HbH disease з 240 жінками контрольної групи продемонструвало істотний ризик затримки розвитку плода, передчасних пологів, низької ваги, що сукупно підвищує перинатальну смертність. Жінкам проводились гемотрансфузії для підтримки рівня гемоглобіну вище 7,0 г/дл. Не виявлено істотної асоціації з такими частими акушерськимими ускладнення як прееклампсія, до та після пологові кровотечі. Частота прееклампсії склала 18%, а серцевої недостатності 9% протягом 34 вагітностей 29 тайських жінок, в той час як в Італії 5,5% жінок мали прееклампсію і жодна не мала серцевої недостатності. Дослідження на Сардинії повідомляє про 11% самовільного переривання – на рівні показника в даній популяції. Тобто, більшість жінок з HbH disease можуть завершити вагітність без ускладнень і народити здорову дитину.
Пологи.
Залишається суперечливим питання, чи таласемія сама по собі є показом до кесаревого розтину. Найчастішими показами до такого родорозрішення називають цефалотазову диспропорцію внаслідок короткого зросту та/або скелетних деформацій. Згідно з одним повідомленням рівень кесарського розтину становить 19%. При щелепних деформаціях слід обирати епадуральну анестезію, але зважати при цьому на сколіоз та остеопороз.
Грудне вигодовування:
Рівень грудного вигодовування значно нижчий від популяційного. До появи антивірусних препаратів прямої дії існувало переконання, що грудне вигодовування підвищує ризик передачі вірусного гепатиту. На сьогодні основною причиною відмови є потреба у відновленні хелатної терапії одразу після пологів. Хоча відсутні повідомлення про присутність в грудному молоці людини препарату деферасірокс або його метаболітів, відомо, що у тварин препарат швидко проникає до молока, досягаючи концентрації, вищої від показника в плазмі матері. Також невідомо, чи інший препарат – деферипрон – проникає до грудного молока. Дефероксамін не абсорбується при пероральному введенні і його конценртація в грудному молоці видається дуже низькою. Таким чином, дефероксамін є єдиним хелатором, який може бути безпечним в період грудного вигодовування.
ХЕЛАТНА ТЕРАПІЯ
*Хелатор – речовина, яка здатна утворювати зв’язок з іншими речовинами.
Репродуктивні дослідження у не завантажених залізом щурів та кролів продемонстрували тератогенність та ембріотоксичність деферипрону (зменшення виживання потомства та аномалії нирок у потомства чоловічої статі) на фоні доз, які призводять до системного впливу значно нижчого від клінічного. Не виявлено негативного впливу при використанні доз, еквівалентних використовуваним у людини. Контрольованих досліджень у людини в період вагітності не проводилось. Повідомляється про успішні вагітності після випадкового лікування деферипроном або деферасіроксом.
Незважаючи на такі повідомлення,
|
ПЕРОРАЛЬНІ ХЕЛАТОРИ ЗАЛІЗА ПРОТИПОКАЗАНІ ВАГІТНИМ ЧЕРЕЗ ВІДСУТНІСТЬ КОНТРОЛЬОВАНИХ ДАНИХ |
Потенційна токсичність дефероксаміну базується на даних від експериментальних тварин. Відповідно до експериментальних моделей плацентарний трансфер деферасіроксу у щурів є мінімальним. Експерименти у вагітних мишей продемонстрували вплив на формування кісток тільки на фоні дози, яка у 5 разів перевищувала максимальну добову для людини. Виробник повідомляє про аналогічні результати у кролів. Проте, огляд даних щодо вагітних з таласемією продемонстрував, що десятки таких жінок отримували дефероксамін понад кілька тижнів чи місяців вагітності без токсичних та тератогенних наслідків. Більш того, є сумніви, чи дефероксамін проникає через плаценту, зважаючи на розмір молекули.
|
ЖІНКАМ РЕПРОДУКТИВНОГО ВІКУ З ТАЛАСЕМІЄЮ, ЯКІ ПРИЙМАЮТЬ ХЕЛАТОРИ, СЛІД РЕКОМЕНДУВАТИ УНИКАТИ ВАГІТНОСТІ АБО ПЕРЕХОДИТИ НА ДЕФЕРОКСАМІН У ВИПАДКУ ПЛАНУВАННЯ ВАГІТНОСТІ. |
| У ВИПАДКУ ЗНАЧНОГО ПЕРЕВАНТАЖЕННЯ СЕРЦЯ ТА ПЕЧІНКИ ЗАЛІЗОМ МОЖНА РОЗГЛЯНУТИ ВІДНОВЛЕННЯ ХЕЛАТНОЇ ТЕРАПІЇ ДЕФЕРОКСАМІНОМ НАПРИКІНУЦІ ДРУГОГО ТРИМЕСТРУ ВАГІТНОСТІ, ЗВАЖИВШИ ПЕРЕВАГИ ДЛЯ МАТЕРІ |
СЕРПОВИДНОКЛІТИННА АНЕМІЯ
Серповидноклітинна анемія (Sickle cell disease (SCD) – це група генетичних захворювань, які виникають внасдлідок точкових мутацій в бета-субодиниці гену глобіну, що призводить до серпоподібної форми гемоглобіну (HbS). Можливий гомозиготний стан (HbSS) – це є серповидноклітинна анемія та компаунд гетерозигота з різними варіантами гемоглобіну, найчастіше з гемоглобіном С (HbC) (утворюється HbSC). Клінічний фенотип дуже різноманітний.
| ОСНОВНІ СИМПТОМИ СЕРПОВИДНОКЛІТИННОЇ АНЕМІЇ |
| АНЕМІЯ (нормальні еритроцити живуть приблизно 120 днів, а серповидноклітинні гинуть через 10-20 днів, що призводить до дефіциту еритроцитів) |
| КРИЗИ –періодичні епізоди болю (закупорка судин еритроцитами аномальної форми) |
| НАБРЯКИ РУК І НІГ (блокування судин еритроцитами аномальної форми) |
| ЧАСТІ ІНФЕКЦІЇ (ураження селезінки) |
| ЗАТРИМКА РОСТУ ТА ПУБЕРТАТУ (недостатність кисню та нутрицієнтів ) |
|
ПРОБЛЕМИ ІЗ ЗОРОМ – СІТКІВКОЮ |
РЕКОМЕНДАЦІЇ ДЛЯ ЖІНОК РЕПРОДУКТИВНОГО ВІКУ ІЗ СЕРПОВИДНОКЛІТИННОЮ АНЕМІЄЮ
| ПРЕКОНЦЕПЦІЯ – ПЛАНОВАНА ВАГІТНІСТЬ |
| ТЕСТУВАННЯ ПАРТНЕРА НА СЕРПОВИДНОКЛІТИННУ АНЕМІЮ |
| В ЗАЛЕЖНОСТІ ВІД СТАТУСУ ПАРТНЕРА ТА МОЖЛИВИХ ПРОБЛЕМ З НАСТАННЯМ ВАГІТНОСТІ – ВИКОРИСТАТИ АЛГОРИТМ, ОПИСАНИЙ В РОЗДІЛІ ПРО ТАЛАСЕМІЮ |
| ВИКОНАТИ КАЛЕНДАР ІМУНІЗАЦІЇ (ПНЕВМОКОК, ГРИП, ПНЕВМОНІЯ) |
| НЕ ВАГІТНІТИ ПРОТЯГОМ 6 ТИЖНІВ ПІСЛЯ ВВЕДЕННЯ ЖИВОЇ ВАКЦИНИ |
| ФОЛІЄВА КИСЛОТА В ДОЗІ 5 МГ НА ДЕНЬ |
| ЖІНКИ, ЯКІ ПРИЙМАЮТЬ ГІДРОКСИСЕЧОВИНУ: РОЗГЛЯДАТИ ПИТАННЯ ПРО ПРИЗУПИНЕННЯ ЛІКУВАННЯ |
| ПРИМІТКА: ЯКЩО МУЖЧИНА З СЕРПОВИДНОКЛІТИННОЮ АНЕМІЄЮ ПРИЙМАЄ ГІДРОКСИСЕЧОВИНУ, ТО РЕКОМЕНДУЄТЬСЯ АБО ПРИЗУПИНИТИ ЛІКУВАННЯ ПЕРЕД ПЛАНОВАНОЮ ВАГІТНІСТЮ, АБО КРІОКОНСЕРВУВАТИ СПЕРМУ ПЕРЕД ПОЧАТКОМ ЛІКУВАННЯ |
Ускладнення в період вагітності (результати 21 дослідження з охопленням 26349 жінок з серповинноклітинною анемією та асоційованими гемоглобінопатіями).
| ПІДВИЩЕННЯ МАТЕРИНСЬКОЇ СМЕРТНОСТІ: в розвинутих країнах приблизно <1%, в слабо розвинутих – до 10% через відсутність антенатальної допомоги |
| ПІДВИЩЕННЯ ЧАСТОТИ ПЕРИНАТАЛЬНОЇ СМЕРТНОСТІ: в розвинутих країнах приблизно 5%, в слабо розвинутих вища частота |
| ПЕРЕДЧАСНІ ПОЛОГИ 20%. Вища частота на 34 та 38 тижнях вагітності. Вдвічі вища у жінок з HbSS. |
| ЗАТРИМКА ВНУТРІШНЬОУТРОБНОГО РОЗВИТКУ ЧАСТО: приблизно 20% дітей з вагою нижче 10 перцентиля, ймовірно, внаслідок вазооклюзії у матково-плацентарному кровообігу, що призводить до підвищення частоти інфарктів та відшарування плаценти. |
| ГІПЕРТЕНЗІЯ: гестаційна та прееклампсія – 1/3 вагітних |
| ПІДВИЩЕННЯ РИЗИКУ ТРОМБОЗУ: постійна активація тромбоцитів та згортання крові. ЖІНОК СЛІД МОНІТОРУВАТИ ЯК ГРУПУ ВИСОКОГО РИЗИКУ ВЕНОЗНОЇ ТРОМБОЕМБОЛІЧНОЇ ХВОРОБИ |
| ПІДВИЩЕННЯ ЧАСТОТИ ІНФЕКЦІЙ внаслідок гіпоспленізму, а також через змінену активацію комплементу. Найчастіше зустрічаються інфекції сечової системи, що може призводити до пієлонефриту, також вищою є частота пневмоній і ураження кісток. Всі види інфекцій підвищують ризик больових кризів. |
ВАГІТНІСТЬ – ПОСТІЙНИЙ СУПРОВІД: рекомедації вагітним та лікарям
| ПРОДОВЖУВАТИ ПРИЙОМ ФОЛІЄВОЇ КИСЛОТИ | |
| ПОЯСНИТИ ЖІНЦІ, ЩО ВОНА ПОВИННА ЗВЕРТАТИСЬ В ЛІКАРНЮ ПРИ ПОЯВІ БОЛЕЙ (кризів), особливо у ІІІ триместрі, коли більшість кризів і виникає | |
| ЧІТКО ЗАЗНАЧАТИ В МЕДИЧНІЙ ДОКУМЕНТАЦІЇ ДІАГНОЗ СЕРПОВИДНОКЛІТИННОЇ АНЕМІЇ | |
| НАДАТИ ЖІНЦІ ЧІТКИЙ ПЛАН ЛІКУВАННЯ, який вона повинна мати при собі, особливо на випадок виникнення кризи (контакт лікуючого лікаря, деталі початкового лікування (внутрішньовенне введення рідини, знеболення, показники, які вимагають переливання крові або замінного переливання) |
|
| НЕСТЕРОЇДНІ ПРОТИЗАПАЛЬНІ ПРЕПАРАТИ ПРОТИПОКАЗАНІ ДО 12 ТИЖНІВ ВАГІТНОСТІ ТА ПІСЛЯ 32 ТИЖНІВ ВАГІТНОСТІ |
|
| ІНТЕНСИВНЕ ЛІКУВАННЯ ТОКСИКОЗУ ВНУТРІШНЬОВЕННОЮ ГІДРАТАЦІЄЮ ДЛЯ ПОПЕРЕДЖЕННЯ КРИЗІВ | |
| З 20 ТИЖНЯ ВАГІТНОСТІ РЕТЕЛЬНИЙ МОНІТОРИНГ РОСТУ ПЛОДА (УЗД) | |
| ЩОМІСЯЦЯ: розгорнутий аналіз крові з формулою, оцінка рівня гемоглобіну та тромбоцитів | |
| ЩОМІСЯЦЯ: посів сечі для контролю сечових інфекцій та попередження їх | |
| ПРОДЕМОНСТРОВАНО, ЩО РУТИННІ ПРОФІЛАКТИЧНІ ГЕМОТРАНСФУЗІЇ МОЖУТЬ ЗНИЗИТИ РИЗИК НАСТУПНИХ УСКЛАДНЕНЬ: материнська смертність, вазо-оклюзивні епізоди, легеневі ускладнення, передчасні пологи, смертність новонароджених. Тобто, ЖІНКАМ, ЯКИМ ТАКІ МАНІПУЛЯЦІЇ ПРОВОДИЛИСЬ ДО ВАГІТНОСТІ СЛІД ПРОДОВЖИТИ ЇХ І У ПЕРІОД ВАГІТНОСТІ (рішення приймається за участю гематолога, який наглядає жінку) | |
| В той же час відомо, що регулярні трансфузії супроводжуються ризиком алоімунізації, ізоімунізації, інфікування, перевантаження залізом | |
| Поки що не доведена ефективність трансфузій жінкам, які до вагітності такого лікування не отримували | |
| ПОКАЗИ ДО ГЕМОТРАНСФУЗІЇ ВИЗНАЧАЄ ГЕМАТОЛОГ, ОСНОВНІ КРИТЕРІЇ НАСТУПНІ: |
|
| У 10-20% ЖІНОК ІЗ СЕРПОВИДНОКЛІТИННОЮ АНЕМІЄЮ Є РИЗИК ІЗОІМУНІЗАЦІЇ ЕРИТРОЦИТІВ. ЦЕ МОЖЕ СПРИЧИНЯТИ ГЕМОЛІТИЧНУ ХВОРОБУ У НОВОНАРОДЖЕНИХ ТА УПОВІЛЬНЕНІ ГЕМОЛІТИЧНІ ТРАНСФУЗІЙНІ РЕАКЦІЇ У МАТЕРІ. НАЙЧАСТІШЕ ФОРМУЮТЬСЯ АНТИЕРИТРОЦИТАРНІ АНТИТІЛА ДО С, Е ТА KELL АНТИГЕНІВ. СЛІД ФЕНОТИПУВАТИ КРОВ НА ВІДПОВІДНІСТЬ МАТЕРИНСЬКИМ С, Е ТА KELL АНТИГЕНАМ. КРОВ МАЄ БУТИ ЗБІДНЕНА НА ЛЕЙКОЦИТИ ТА НЕГАТИВНА ВІДНОСНО ЦИТОМЕГАЛОВІРУСУ – ДЛЯ ЗМЕНШЕННЯ РИЗИКУ ТРАНСМІСІЇ ІНФЕКЦІЇ |
|
СУПРОВІД ВАГІТНОЇ В ПЕРІОД КРИЗИ: короткі рекомендації
| 1/3 ЖІНОК З ГЕНОТИПОМ HbSS та HbSC має кризи |
| Кризи розвиваються переважно в ІІІ триместрі |
| Профілактична госпіталізація в ІІІ триместрі |
| Залучати гематолога та інших спеціалісті за потреби |
| Моніторинг стану оксигенації – утримувати сатурацію на рівні >94% |
| 3–4 літри рідини перелити протягом 24 годин на фоні ретельного моніторингу балансу рідини |
| При болі починати з парацетамолу, надалі більшість жінок потребують призначення опіатів |
| Жінкам, які через часті кризи мають звикання до опіатів проводиться анестезія |
| Антибіотики при інфікуванні та лихоманці |
| Низькомолекулярні гепарини для профілактики тромбоутворення при потребі |
| При гострому грудному синдромі – респіраторна фізична терапія зі стимулюючою спірометрією |
ПОЛОГИ
| Вибір тактики залежить від акушерських обставин, а не основного захворювання |
| Планові пологи тільки у жінок з регулярними трансфузіями та замінним переливанням, щоб їх провести при оптимальному рівні гемоглобіну |
| Тобто, серповидноклітинна анемія не є протипоказом до вагінальних пологів |
| Домашні пологи не рекомендовані |
| Жінок слід тримати в теплі, добре гідратувати внутрішньовенним введенням рідини в пологах та післяпологовому періоді |
| Потрібен суворий моніторинг кількості введеної рідини та виділеної сечі |
| Постійний кардіотокографічний моніторинг через можливі ускладнення (дистрес плоду, мертвонародження, відшарування плаценти) |
| При бажанні доцільною є епідуральна анестезія |
| Не затягувати пологи та розрив мембран |
| Якщо стан жінки потребує кесарського розтину, перевагу слід надати нейроаксіальній анестезії, а не загальній, щоб знизити ризик вазооклюзивного кризу |
| Призначати низькомолекулярні гепарини для профілактики тромбозу протягом 6-ти тижнів після пологів, жінки повинні носити панчохи з градуйованою компресією |
| Моніторувати новонароджених на предмет абстинентного синдрому, якщо мама приймала тривало опіоїди для зменшення болю при кризах |
| Питання відносно прийому гідроксисечовини до кінця не вирішене, препарат не є абсолютно протипоказаним |
| Продовжувати нагляд гематолога |
Грудне вигодовування: серповидноклітинна анемія не є протипоказом для вигодовування новонародженого, деякі спеціалісти навіть це рекомендують. Потрібно контролювати, чи призначені жінці препарати проникають до грудного молока і надавати перевагу тим, які слабо або взагалі не потрапляють до новонародженого з грудним молоком.
ВИСНОВКИ
щодо перебігу/моніторингу вагітності у жінок з гемоглобінопатіями (велика таласемія, проміжна таласемія, сервповидноклітинна анемія)
| НАГЛЯД МУЛЬТИДИСЦИПЛІНАРНОЇ КОМАНДИ |
| МОНІТОРИНГ ВІД ПЕРІОДУ ПРЕКОНЦЕПЦІЇ ДО ПІСЛЯПОЛОГОВОГО ПЕРІОДУ |
| ПЛАНУВАННЯ ПОЛОГІВ В ЗАЛЕЖНОСТІ ВІД ЛІКУВАННЯ ДЛЯ ВИБОРУ ОТРИМАЛЬНОГО СТАНУ ЖІНКИ |
| РЕТЕЛЬНИЙ МОНІТОРИНГ МАТЕРІ ТА ДИТИНИ |
| КЕРУВАТИСЬ ЧІТКИМИ ПРОТОКОЛАМИ ВІДПОВІДНО ДО НОЗОЛОГІЇ щодо супроводу та лікування (хелатна терапія або гемотрансфузії) |
Адаптовано за матеріалами:
- Teratology and Drugs in Pregnancy. Niebyl, J, Simpson, J, libr. women’s med., (ISSN: 1756-2228)2008; DOI 10.3843/GLOWM.10096.
- Origa R, Comitini F. Pregnancy in Thalassemia. Mediterr J Hematol Infect Dis. 2019 Mar 1;11(1):e2019019. doi: 10.4084/MJHID.2019.019. PMID: 30858957; PMCID: PMC6402552.
- Mojtahedzadeh F, Kosaryan M, Mahdavi MR, Akbari J. The effect of folic acid supplementation in beta-thalassemia major: a randomized placebo-controlled clinical trial. Arch Iran Med. 2006 Jul;9(3):266-8. PMID: 16859064.
- Facial Presentation in People with Beta-Thalassemia Major. Інформація з сайту Healthline Media LLC.
- Thalassemias. Інформація з сайту Cleveland Clinic.
- Brewin JN, Nardo-Marino A, Stuart-Smith S, El Hoss S, Hanneman A, Strouboulis J, Menzel S, Gibson JS, Rees DC. The pleiotropic effects of α-thalassemia on HbSS and HbSC sickle cell disease: Reduced erythrocyte cation co-transport activity, serum erythropoietin, and transfusion burden, do not translate into increased survival. Am J Hematol. 2022 Oct;97(10):1275-1285. doi: 10.1002/ajh.26652. Epub 2022 Jul 18. PMID: 35802781; PMCID: PMC9543574.
- Sickle cell anemia. Інформація з сайту “Mayo Clinic”.
- Sorrentino F, Maffei L, Caprari P, et al. Pregnancy in Thalassemia and Sickle Cell Disease: The Experience of an Italian Thalassemia Center. Frontiers in Molecular Biosciences. 2020 ;7:16. DOI: 10.3389/fmolb.2020.00016. PMID: 32118041; PMCID: PMC7033579.
Адаптовано 05.04.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 05.04.2023 р.
СІПОНІМОД
Назва англійською мовою: Siponimod.
Група/призначення:
Імуномодулятор, модулятор сфінгозин 1-фосфат рецептору (Sphingosine 1-Phosphate (S1P) Receptor). Основний показ – лікування розсіяного склерозу. Це хворобо-модифікуюча терапія.
Альтернативні назви / синоніми: майзент.
Діюча речовина: сіпонімод.
Рекомендації при вагітності: протипоказаний.
Рекомендації при лактації:
Відсутні дані – потенційно токсичний.
Прийом під час вагітності (короткий висновок):
Сіпонімод впливає на сфінгозин 1-фосфат рецептори, які залучені до процесу ангіогенезу та формування судин в період ембріогенезу. Призначений для лікування пацієнтів з релаксуючою формою розсіяного склерозу для зменшення частоти клінічних загострень.
Відсутні повідомлення про використання в період вагітності у людини. Дані від експериментальних тварин припускають ризик, проте відсутність досвіду застосування у людини не дозволяє оцінити ембріо/фетальний ризик.
На даний час керуємось рекомендаціями виробника:
|
РЕКОМЕНДОВАНО:
|
| У ВИПАДКУ НАСТАННЯ ВАГІТНОСТІ НА ФОНІ ЛІКУВАННЯ СІПОНІМОДОМ ЖІНКУ СЛІД ІНФОРМУВАТИ ПРО ПОТЕНЦІЙНИЙ РИЗИК ДЛЯ ПЛОДА |
| У ПАЦІЄНТІВ З РОЗСІЯНИМ СКЛЕРОЗОМ ПІСЛЯ ПРИПИНЕННЯ ЛІКУВАННЯ СІПОНІМОДОМ НАСТУПАЄ НЕЗВОРОТНЕ ПОГІРШЕННЯ СТАНУ |
|
ЖІНКИ З РОЗСІЯНИМ СКЛЕРОЗОМ МОЖУТЬ ЗАРЕЄСТРУВАТИСЬ В ПОСТІЙНО ДІЮЧОМУ РЕЄСТРІ ВАГІТНИХ ВІД ТЕРАТОЛОГІЧНОЇ СЛУЖБИ OTIS/MotherToBABY |
| ВАЖЛИВО: відомо про взаємодію сіпонімоду з 674 лікарськими засобами, 7 станами/захворюваннями (кардіоваскулярні (виражена взаємодія: протипоказаний пацієнтам з анамнезом інфаркту, ішемії, нестабільної стенокардії, серцевої недостатності тощо), порушення функції печінки, інфекції (препарат підвищує ризик інфікування), макулярний набряк, порушення дихальної функції, вакцинація (протипоказано використовувати живі вакцини), енцефалопатія, погіршення стану пацієнтів з розсіяним склерозом після відміни препарату); щодо взаємодії з препаратами, то з 543 вона є вираженою, з 129 – помірною, з 2 – незначною. Перелік препаратів, які взаємодіють з сіпонімодом доступний за посиланням: Siponimod Interactions Checker – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. |
Інформація щодо досліджень на тваринах:
Репродуктивні дослідження проводились у щурів та кролів. Вплив сіпонімоду в період органогенезу у щурів призводив до постімплантаційних втрат та мальформацій вісцеральних органів і скелету на фоні найнижчої з тестованих доз, яка у 18 разів перевищувала рекомендовану для людини дозу (2 мг кг/день). Дози понад 0,05 мг/кг – нижчі за рекомендовану для людини – використовувані в період вагітності та лактації підвищували рівень смертності, знижували вагу тіла, затримували сексуальне дозрівання. Мальформації спостерігали на фоні всіх тестованих доз. У кролів дози, двократні рекомендованій для людини, спричиняли ембріолетальні наслідки та підвищували частоту скелетних і вісцеральних мальформацій.
Дослідження карциногенності у мишей і щурів продемонстрували підвищення частоти злоякісних лімфом у самок та гемангіосарком, комбінованих гемангіом, гемангіосарком у самців і самок. Самці, які зазнали впливу препарату мали підвищений ризик фолікулярних аденом щитоподібної залози та комбінованої фолікулярної аденоми і карциноми щитоподібної залози. Вважається, що таке явище обумовлене підвищенням індукції печінкових ферментів у щурів і не стосується людини.
Численні дослідження мутагенності були негативними. Призначення препарату самкам перед паруванням і до 6 дня вагітності не порушувало фертильності.
Інформація щодо впливу на плід:
Характеристики препарату: рівень зв’язування з білками плазми становить 99,9%, період напіввиведення – 30 годин.
Плацентарний трансфер: невідомо, чи сіпонімод проникає через плаценту. Молекулярна вага та високий рівень зв’язування з білками плазми обмежуватимуть такий процес, але подовжений період напіввиведення може все ж таки цьому сприяти.
Контрольованих досліджень у людини не проводилось.
Застосування препарату під час вигодовування:
Відсутня інформація про використання сіпонімоду в період лактації у людини. Молекулярна вага препарату та високий рівень зв’язування з білками плазми обмежують екскрецію до грудного молока. Але довгий період напіввиведення може сприяти такому процесу. Препарат є потенційно токсичним для немовляти.
Найчастішими ефектами у дорослих у випадку лікування сіпонімодом є головний біль, гіпертензія, підвищення рівня трансамінази.
Оскільки близький за дією препарат фінголімод протипоказаний в період грудного вигодовування, то слід керуватись наступним:
| Більшість експертів вважають, що слід робити вибір між лікуванням матері та грудним вигодовуванням, керуючись станом матері |
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Towers C, Forinash A. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. 12th edition, 2022, Wolters Kluwer. 1461 pages. ISBN: 978-1975-1-6237-5.
- Siponimod (Mayzent) Use During Pregnancy. Інформація з бази даних “Drugs.com”.
- Mayzent (siponimod). Інформація з сайту MS Australia.
- Інформаційна система “Teratogen Information System (TERIS)”.
- Mayzent (Siponimod Tablets): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі WebMD.
- Siponimod – NCBI Bookshelf (nih.gov). База даних “Drugs and Lactation Database (LactMed)”.
- Mayzent – Summary of Product Characteristics. Інформація з сайту Європейського агентства з лікарських засобів“European Medicines Agency”.
- Siponimod Oral – What You Should Know About Taking siponimod oral when pregnant, nursing, or administering to children or adults over 60. Інформація з сайту WebMD.
- MAYZENT – siponimod tablet, film coated. Інформація з сайту “DAILYMED – US National Library of Medicine”.
Адаптовано 03.04.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 03.04.2023 р.
ФІНГОЛІМОД
Назва англійською мовою: Fingolimod.
Група/призначення:
Імуномодулятор, модулятор сфінгозин 1-фосфат рецепторів (Sphingosine 1-Phosphate (S1P) Receptor). Основний показ – лікування розсіяного склерозу. Це хворобо-модифікуюча терапія.
Альтернативні назви / синоніми: фінмод, гіленія.
Діюча речовина: фінголімод.
Рекомендації при вагітності: протипоказаний.
Рекомендації при лактації: протипоказаний.
Прийом під час вагітності (короткий висновок):
Фінголімод впливає на сфінгозин 1-фосфат рецептори, які залучені до процесу ангіогенезу та формування судин в період ембріогенезу. Активний метаболіт фінголімод-фосфат зв’язується з високою афінністю з рецепторами сфінгозин 1-фосфату та блокує здатність лімфоцитів виходити з лімфоовузлів. Фінголімод призначений для лікування пацієнтів з релаксуючою формою розсіяного склерозу для зменшення частоти клінічних загострень. У двох видів тварин спостерігали токсичний вплив на розвиток. Виходячи з періоду напіввиведення препарату виробник рекомендує припинити лікування, принаймні, за 2 місяці до спроби завагітніти.
Дані про використання у вагітних жінок суперечливі, так, постмаркетингові дані свідчать про двократне підвищення частоти великих вроджених вад, в той час як інше велике дослідження таких фактів не виявило, тому найкращою є рекомендація від виробника:
|
РЕКОМЕНДОВАНО:
|
| У ВИПАДКУ НАСТАННЯ ВАГІТНОСТІ НА ФОНІ ЛІКУВАННЯ ФІНГОЛІМОДОМ ЖІНКУ СЛІД ІНФОРМУВАТИ ПРО ПОТЕНЦІНИЙ РИЗИК ДЛЯ ПЛОДА ТА ЗУПИНИТИ ПРИЙОМ ПРЕПАРАТУ |
| В ТОЙ ЖЕ ЧАС У ПАЦІЄНТІВ З РОЗСІЯНИМ СКЛЕРОЗОМ ПІСЛЯ ПРИПИНЕННЯ ЛІКУВАННЯ ФІНГОЛІМОДОМ НАСТУПАЄ НЕЗВОРОТНЕ ПОГІРШЕННЯ СТАНУ (в межах 11 тижнів) |
| ДОСТУПНИЙ РЕЄСТР ВАГІТНИХ, ЯКІ ОТРИМУВАЛИ ФІНГОЛІМОД/ГІЛЕНІЯ ЗА МІНІМУМ 8 ТИЖНІВ ДО ВАГІТНОСТІ ТА В ПЕРІОД ВАГІТНОСТІ – ДЛЯ ЛІКАРІВ, ЯКІ СУПРОВОДЖУЮТЬ/МОНІТОРУЮТЬ ЦИХ ЖІНОК https://www.gilenyapregnancyregistry.com |
|
ЖІНКИ З РОЗСІЯНИМ СКЛЕРОЗОМ МОЖУТЬ ЗАРЕЄСТРУВАТИСЬ В ПОСТІЙНО ДІЮЧОМУ РЕЄСТРІ ВАГІТНИХ ВІД ТЕРАТОЛОГІЧНОЇ СЛУЖБИ OTIS/MotherToBABY |
| ВАЖЛИВО: відомо про взаємодію фінголімоду з 594 лікарськими засобами, 8 станами/захворюваннями (кардіоваскулярні (виражена взаємодія: протипоказаний пацієнтам з анамнезом інфаркту, ішемії, нестабільної стенокардії, серцевої недостатності тощо), гіпертонія, порушення функції печінки, інфекції (препарат підвищує ризик інфікування), макулярний набряк, порушення дихальної функції, енцефалопатія, погіршення стану пацієнтів з розсіяним склерозом після відміни препарату); щодо взаємодії з препаратами, то з 444 вона є вираженою, з 148 – помірною, з 2 – незначною. Перелік препаратів, які взаємодіють з фінголімодом доступний за посиланням: https://www.drugs.com/drug-interactions/fingolimod-index.html, де можна ввести назву препарату для перевірки такої взаємодії. |
Інформація щодо досліджень на тваринах:
Репродуктивні дослідження проводились у щурів та кролів. У щурів пероральні дози на рівні 0,03-10 мг/кг/день підвищували частоту мальформацій та загибелі ембріонів/плодів, окрім на фоні найнижчої використаної дози. В цьому дослідженні найнижча доза була нижчою від рекомендованої для людини. У щурів найчастіше зустрічались наступні мальформації: персистуючий артеріальний стовбур (загальний артеріальний стовбур) та дефект міжшлуночкової перетинки. У випадку призначення фінголімоду протягом вагітності та лактації в дозах 0,05-0,5 мг/кг/день спостерігали зниження рівня виживання дитинчат, а дефіцит навчання – на фоні найвищої дози. В цьому дослідженні найнижча доза була на рівні рекомендованої для людини. Щодо кролів: підвищення частоти смертності ембріонів/плодів, затримка росту на фоні доз від 1,5 до 5 мг/кг/день. У кролів, дозою, яка не призводила до негативних наслідків була 20-кратна рекомендованій для людини.
Фінголімод продемонстрував карциногенність у мишей, але не у щурів. Численні дослідження мутагенності були негативними. У щурів не виявлено впливу на фертильність ані самок, ані самців.
Інформація щодо впливу на плід:
Фінголімод та його активний метаболіт мають високий рівень зв’язування з білками (99,7%). Термінальний період напіввиведення обох сполук становить 6-9 днів.
Невідомо, чи фінголімод або його активний метаболіт проникають через плаценту у людини. Молекулярна вага та довгий період напіввиведення припускають такий трансфер, але цей процес обмежуватиметься високим рівнем зв’язування з білками.
Дослідження 2014 року повідомляє результати вагітностей після пренатального впливу фінголімоду в ІІ-IV фазах клінічних досліджень (N=66). Вплив відбувався протягом 6 тижнів від запліднення або під час запліднення і тривав ще 1-141 день. Результати наступні: 9 (14%) спонтанних абортів, 24 (36%) медичних абортів, 28 (42%) народжених живими, 4 вагітності, які ще тривали на момент повідомлення, 1 вагітність, втрачена з-під нагляду. Вплив фінголімоду в І триместрі спричинив 5 мальформацій (7,6%): 2 у народжених живими (однобічний постеріомедіальний вигин великої гомілкової кістки, акранія) та 3 у плодів, вагітності якими були перервані за медичними показами (тетрада Фалло, спонтанна внутрішньоутробна загибель плода, порушення розвитку плода). У трьох жінок вагітності наступили через 6 тижнів після останньої дози фінголімоду (0,5 мг) з наступними результатами: 7 здорових дітей, 1 медичний аборт.
Повідомляється про 34-річну жінку з 10-річним анамнезом розсіяного склерозу, яка приймала фінголімод в дозі 0,5 мг протягом перших 7 тижнів вагітності. Лікування було припинено, в нормальних вагінальних пологах народилась дитина з декстракардією без структурних дефектів серця та інших органів.
Дослідження 2018 року використало дані клінічних досліджень, обсерваційних досліджень, наглядових програм та окремих повідомлень для оцінки ризику несприятливих результатів вагітності у жінок з розсіяним склерозом, які зазнали впливу фінголімоду безпосередньо перед або під час вагітності. Згідно з цим аналізом, поширеність великих вроджених вад серед народжених живими не була істотно вищою від загальнопопуляційних показників в групі без розсіяного склерозу. Аналогічні результати отримано для самовільного переривання та вроджених вад серця. Не знайдено специфічного патерну вроджених вад.
Європейське агентство з лікарських засобів “European Medicines Agency” застерігає від використання фінголімоду у вагітних, виходячи з постмаркетингових даних, які свідчать про двократне підвищення частоти великих вроджених вад у випадку лікування фінголімодом в порівнянні із загальнопопуляціним рівнем (2-3%; EUROCAT). Мова йде про наступні вроджені вади: вроджена вада серця (дефект міжшлуночкової перетинки, дефект міжпередсердної перетинки, тетрада Фалло), аномалії нирок, аномалії кістково-м’язової системи.
Виробник повідомив про результати 1246 проспективно супроводжуваних вагітностей (1255 новонароджених) станом на лютий 2017 року. Великі вроджені вади за виключенням хромосомних аномалій зареєстровані у 3,9% народжених живими. Разом з мервонародженнями та перерваними вагітностями показник зріс до 4,5%. Частота вад серця склала 1,5% серед народжених живими та 1,6% серед всіх категорій. Такі показники є в межах загальнопопуляційних. При порівнянні 63 вагітностей з впливом фінголімоду з 62 вагітностями з впливом інтерферону-бета асоціація з вродженими вадами також не була статистично істотною – 4,8% проти 2,3% (співвідношення шансів 2,2, 95% ДІ 0,2-24,6), виходячи з інформації про 2 дітей з вадами в групі фінголімоду проти 1 дитини в іншій.
Застосування препарату під час вигодовування:
Відсутня інформація про використання фінголімоду в період грудного вигодовування. Молекулярна вага та довгий період напіввиведення припускають екскрецію основного препарату та його метаболіту до грудного молока, але високий рівень зв’язування з білками плазми обмежуватиме цей процес. Наслідки такого впливу на немовля невідомі.
Згідно з інструкцією до препарату він проникає до молока щурів, виходячи з цих даних виробник оцінив, що немовля може отримати 30% від материнської дози.
Інші джерела повідомляють, що у молоці тварин рівень препарату в 2-3 рази перевищував показник в плазмі матері. При цьому не спостерігали впливу на вагу тіла, розвиток, поведінку, фертильність.
На думку одного оглядача, навіть невелика кількість препарату в грудному молоці буде проникати перорально до немовляти.
| Більшість експертів вважають, що слід робити вибір між лікуванням матері та грудним вигодовуванням, керуючись станом матері |
Вплив на фертильність (чоловіків та жінок):
У доклінічних дослідженнях фінголімод не чинив несприятливого впливу на фертильність самців і самок щурів на фоні доз до 10 мг/кг/день, що у 200 разів вище від рекомендованої для людини дози, виходячи з поверхні тіла. Лікування фінголімодом захистило яєчники мавп і людини від деструктивного впливу опромінення 15 Гр (стаття Рентгенівське опромінення та вагітність). Ліковані фінголімодом мавпи змогли завагітніти і виносити потомство після дози опромінення, яка в іншому випадку призвела б до стерильності.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Towers C, Forinash A. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. 12th edition, 2022, Wolters Kluwer. 1461 pages. ISBN: 978-1975-1-6237-5.
- Інформаційна система Центру репродуктивної токсикології “Reprotox”.
- Fingolimod Pregnancy and Breastfeeding Warnings. Інформація з бази даних “Drugs.com”.
- Інформаційна система “Teratogen Information System (TERIS)”.
- Gilenya (Fingolimod Capsules): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі WebMD.
- Fingolimod. База даних “Drugs and Lactation Database (LactMed)”.
- Gilenya – Summary of Product Characteristics. Інформація з сайту Європейського агентства з лікарських засобів“European Medicines Agency”.
- What You Should Know About Taking Fingolimod when pregnant, nursing, or administering to children or adults over 60. Інформація з сайту WebMD.
- DailyMed – FINGOLIMOD capsule (nih.gov) Інформація з сайту “DAILYMED – US National Library of Medicine”.
Адаптовано 03.04.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 03.04.2023 р.
ДЕФЕРАСІРОКС
Назва англійською мовою: Deferasirox.
Група/призначення:
Антидот/хелатор; засоби, що утворюють хелатні сполуки із залізом (хелатоутворювачі, хелатор – речовина, яка здатна утворювати зв’язок з іншими речовинами). Призначається у випадку перенавантаженням залізом в результатів гемотрансфузії.
Альтернативні назви / синоніми: ексіджад, джадену.
Діюча речовина: деферасірокс.
Рекомендації при вагітності: не рекомендований.
Рекомендації при лактації: не рекоменований/протипоказаний.
Прийом під час вагітності (короткий висновок):
В цілому хелатори протипоказані вагітним.
Контрольованих досліджень з деферасіроксом у людини не проводилось. Виходячи з результатів досліджень в експериментальних тварин, не очікується підвищення ризику вроджених вад. Проте в цих дослідженнях було використано дуже низькі дози в порівнянні з тими, що призначають людині, оскільки високі дози спричиняли токсичність у матерів. Таким чином, обмежений досвід застосування у людини не дозволяє адекватно оцінити ризик для ембріону/плода. Інший препарат хелатор заліза – дефероксамін – використовується у вагітних без шкідливого впливу на плід.
| Найкращим рішенням є уникнення призначення деферасіроксу в період органогенезу і призначення тільки при необхідності такого лікування для матері. |
| Деферасірокс може знижувати ефективність гормональних контрацептивів. Рекомендовано використовувати додатковий або альтернативний негормональний метод контрацепції у випадку лікування цим препаратом. |
| ВАЖЛИВО: відомо про взаємодію деферасіроксу з 558 лікарськими засобами, 4 станами/захворюваннями (пригнічення кісткового мозку, дерматологічна токсичність, порушення функції печінки, порушення функції нирок); щодо взаємодії з препаратами, то з 193 вона є вираженою, з 356 – помірною, з 9 – незначною. Перелік препаратів, які взаємодіють з деферасіроксом доступний за посиланням: Deferasirox Drug Interactions – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. |
Інформація щодо досліджень на тваринах:
Призначення деферасіроксу тваринам в період вагітності та лактації призводило до зниження виживання потомства та підвищення частоти аномалій нирок у потомства чоловічої статі на фоні впливу, меншого від отримуваного в людини при використанні рекомендованих доз. Вагітні щури та кролі отримували перорально препарат в період органогенезу в дозах 100 мг/кг/день та 50 мг/кг/день відповідно, що становить 0,8 від максимальної рекомендованої дози для людини, виходячи з мг/м². Ці дози спричиняли материнську токсичність без несприятливого впливу на плід. В іншому дослідженні вагітні щури отримували деферасірокс перорально від органогенезу до 20 дня лактації в дозах 10, 30 та 90 мг/кг/день – відповідно 0,08, 0,2 та 0,7 від максимальної рекомендованої дози для людини, виходячи з мг/м². Материнську токсичність, втрату посліду, зниження виживання потомства спостерігали на фоні дози на рівні 0,7 від максимальної рекомендованої для людини, виходячи з мг/м². Доза 0,2 від максимальної рекомендованої для людини, виходячи з мг/м², продемонструвала підвищення частоти аномалій нирок у потомства чоловічої статі.
Інформація щодо впливу на плід:
Афінність деферасіроксу до цинку та міді значно нижча, аніж до заліза, але можливе також зниження концентрації в плазмі цих металів.
Абсолютна пероральна біодоступність деферасіроксу становить 70%, препарат акумулюється після багаторазового використання. Рівень зв’язування з білками плазми, ексклюзивно з альбуміном, є високим – 99%. Елімінація препарату та його метаболітів відбувається переважно з фекаліями, період напіввиведення становить 8-16 годин.
Плацентарний трансфер: невідомо, чи деферасірокс проникає через плаценту у людини, але його молекулярна вага та довгий період напіввиведення припускають проникнення до ембріону/плода, проте дуже високий рівень зв’язування з білками плазми обмежуватиме такий вплив.
Повідомлення про використання у вагітних жінок:
- Жінки з таласемією лікувались перед вагітністю і припинили лікування у терміні 22, 20 і 12 тижнів вагітності відповідно; новонароджені не мали відхилень;
- 15 жінок з великою бета-таласемією отримували наступні препарати: 4 – деферасірокс, 6 – дефероксамін, 2 – деферипрон, 3 – дефероксамін з деферипроном. Лікування призупинили з настанням вагітності, несприятливих наслідків не виявлено;
- Повідомлення 2016 року інформує про 9 вагітностей 6 жінок з великою бета-таласемією. Лікування зупинили у наступних термінах, в дужках кількість жінок: 6 тижнів (N=4), 8 тижнів (N=3), 10 тижнів (N=1). 8 новонароджених були здоровими, 1 дитина, народжена на 38-му тижнів мала незначні прояви незрілості легень.
Застосування препарату під час вигодовування:
Деферасірокс швидко та інтенсивно проникає до грудного молока у тварин, досягаючи концентрації вищої від рівня в плазмі матері. У щурів не виявляли несприятливого впливу на потомство.
Молекулярна вага та довгий період напівиведення припускають екскрецію до грудного молока людини.
Доступне одне повідомлення про використання деферасіроксу в період лактації у людини: жінка з бета-таласемією почала приймати препарат одразу після пологів. Препарат не визначався в грудному молоці через 2 години після прийому (рівень <0,1 мкг/л). Є повідомлення про немовля, яке знаходилось на грудному вигодовуванні протягом 30 днів і мало нормальний рівень в сироватці феритину та заліза.
У дорослих абсолютна пероральна біодоступність становить 70%, препарат акумулюється після багатьох доз. Рекомендоване лікування деферасіроксом триває місяці, тому виникає побоювання, що таке лікування в період лактації може виснажити рівень заліза у немовляти .
| Більшість джерел вважають, що слід робити вибір між лікуванням матері та грудним вигодовуванням, керуючись станом матері. |
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Towers C, Forinash A. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. 12th edition, 2022, Wolters Kluwer. 1461 pages. ISBN: 978-1975-1-6237-5.
- Інформаційна система Центру репродуктивної токсикології “Reprotox”.
- Deferasirox Pregnancy and Breastfeeding Warnings. Інформація з бази даних “Drugs.com”.
- Інформаційна система “Teratogen Information System (TERIS)”.
- Exjade (Deferasirox): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі WebMD.
- Deferasirox. Інформація з бази даних “Drugs and Lactation Database (LactMed)” – NCBI Bookshelf (nih.gov).
- Teratology and Drugs in Pregnancy. Niebyl, J, Simpson, J, libr. women’s med., (ISSN: 1756-2228)2008; DOI 10.3843/GLOWM.10096.
- Origa R, Comitini F. Pregnancy in Thalassemia. Mediterr J Hematol Infect Dis. 2019 Mar 1;11(1):e2019019. doi: 10.4084/MJHID.2019.019. PMID: 30858957; PMCID: PMC6402552.
- Exjade, INN-deferasirox: Summary of Product Characteristics. Інформація з сайту Європейського агентства з лікарських засобів “European Medicines Agency”.
- What You Should Know About Taking Deferasirox when pregnant, nursing, or administering to children or adults over 60. Інформація з сайту WebMD.
- Deferasirox tablet, film coated. Інформація з сайту “DAILYMED – US National Library of Medicine”.
- Deferasirox (marketed as Exjade) Information. Інформація з сайту Управління з продовольства і медикаментів США (U.S. Food and Drug Administration – FDA).
Адаптовано 20.03.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 20.03.2023 р.
ДЕФЕРИПРОН
Назва англійською мовою: Deferiprone.
Група/призначення:
Засоби, що утворюють хелатні сполуки із залізом (хелатоутворювачі, хелатор – речовина, яка здатна утворювати зв’язок з іншими речовинами), селективний до іонів тривалентного заліза (заліза ІІІ). Препарат має нижчу афінність до міді, алюмінію, цинку.
Схвалений для лікування перевантаження залізом при великій таласемії (thalassemia major).
Це орфанний препарат, схвалений для лікування бета-таласемії, альфа-таласемії, серповидноклітинної анемії, синдрому GRACILE.
Альтернативні назви / синоніми: феррипрокс.
Діюча речовина: деферипрон.
Рекомендації при вагітності:
Дуже обмежені дані про використання у людини – дані від експериментальних тварин припускають ризик – не рекомендовано.
Рекомендації при лактації: не рекомендовано.
Прийом під час вагітності (короткий висновок):
В цілому хелатори протипоказані вагітним. Контрольованих досліджень з деферипроном в людини не проводилось. Відомо, що цей препарат призводить до змін скелету та м’яких тканин у щурів та кролів на фоні доз на рівні 3-4% від максимальної рекомендованої для людини.
Оскільки досвід застосування у людини дуже обмежений, найкращим рішенням буде уникати призначення цього препарату в період органогенезу.
|
РЕКОМЕНДОВАНО:
|
|
| Тобто, відповідно інструкції до препарату, жінкам не слід вагітніти на фоні лікування деферипроном, а якщо все ж таки наступила вагітність, припиняти лікування. |
| ВАЖЛИВО: відомо про взаємодію деферипрону з 277 лікарськими засобами, 2 станами/захворюваннями (агранулоцитоз/нейтропенія; порушення функції печінки); щодо взаємодії з препаратами, то з 223 вона є вираженою, з 54 – помірною. Перелік препаратів, які взаємодіють з деферипроном доступний за посиланням: Deferiprone Interactions Checker – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. |
Інформація щодо досліджень на тваринах:
Репродуктивні дослідження проводились у щурів та кролів. Вплив в період органогенезу на фоні доз на рівні 3-4% від максимальної рекомендованої для людини, виходячи з площі поверхні тіла, призводив до формування мальформацій скелетних та м’яких тканин. У кролів вплив в період органогенезу на фоні дози на рівні 32% від максимальної рекомендованої для людини спричиняв загибель ембріонів/плодів та материнську токсичність.
Досліджень карциногенності не проводилось. Токсикологічне дослідження тривалістю 52 тижні у щурів виявило гіперплазію та пухлини молочних залоз. Численні дослідження мутагенності та кластогенності продемонстрували як позитивні, так і негативні результати. Не спостерігали зміни фертильності чи репродуктивної поведінки у самців та самок щурів, але найвища використана доза становила тільки 25% від максимальної рекомендованої для людини.
Інформація щодо впливу на плід:
Плацентарний трансфер: невідомо, чи деферипрон проникає через плаценту у людини, але його молекулярна вага та низький рівень зв’язування з білками плазми припускають проникнення до ембріону/плода.
Доступні кілька повідомлень про лікування вагітних деферипроном:
- жінка з великою бета-таласемією (анемія Кулі), яка приймала деферипрон або дефероксамін успішно завагітніла в результаті процедури екстракорпорального запліднення, не приймаючи в період вагітності хелатор заліза. Після лікування деферасіроксом жінка завагітніла повторно і припинила хелатну терапія на 22 тижні вагітності. Народилась здорова дитина.
- жінка з великою бета-таласемією приймала деферипрон та інші препарати перші 20 тижнів вагітності. Дитина народилась передчасно через затримку внутрішньоутробного розвитку.
Огляд 2013 року щодо результатів вагітностей жінок з таласемією виявив, що впродовж 129 вагітностей 72 жінок у 81% була припинена хелатна терапія. Не було виявлено різниці в показниках народжених живими та інших серед жінок, які продовжили лікування, проте немає інформації, які конкретні препарати приймались.
Доступні постмаркетингові дані щодо 39 вагітностей жінок, яких лікували деферипроном, та 10 вагітностей від лікованих деферипроном партнерів:
| Кількість | Здорові | Спонтанний аборт | Медичний аборт | Невідомі результати | Вроджена вада розвитку | Внутрішньо-утробна загибель двійні |
| 39 | 23 | 6 | – | 9 | 1* | – |
| 10 | 5+1** | – | 1 | 2 | – | 1 |
Примітки:
*атрезія ануса, нефроптоз, дефект міжпередсердної перетинки, напівхребці, уретральний свищ;
**легка гіпоспадія;
Застосування препарату під час вигодовування:
Через потенційні токсичні наслідки для новонародженого не рекомендоване грудне вигодовування, принаймні, протягом 2 тижнів після останньої дози.
Відсутня інформація про використання деферипрону в період лактації у людини. Молекулярна вага, низький рівень зв’язування з білками (<10%), період напіввиведення (1,9 годин) припускають екскрецію до грудного молока.
Найчастішими побічними наслідками лікування деферипроном у дорослих були хроматурія (забарвлення сечі в темно-коричневий або зелений колір), нудота, блювота, абдомінальний біль, підвищення рівня аланінамінотрансферази, артралгія, нейтропенія. Якщо жінка все ж таки годує дитину грудним молоком на фоні лікування, немовля слід моніторувати на предмет таких ускладнень.
Окремі джерела вважають деферипрон протипоказаним, а не просто не рекомендованим в період лактації.
Вплив на фертильність (чоловіків та жінок):
Лікування не перевантажених залізом щурів не змінювало кількість, рухливість та морфологію сперматозоїдів. Найвища тестована доза, яка становила 25% від максимальної рекомендованої для людини, виходячи з площі поверхні тіла, не продемонструвала негативного впливу на репродуктивну функцію самок і самців. Згідно з фармакологічним оглядом деферипрону від FDA у випадку використання у щурів дози 30 мг/кг/день відзначали подовження діеструсу на 4 і більше днів, що збільшувало час від парування до запліднення, однак, це не порушувало фертильності чи репродуктивної поведінки.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Towers C, Forinash A. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. 12th edition, 2022, Wolters Kluwer. 1461 pages. ISBN: 978-1975-1-6237-5.
- Інформаційна система Центру репродуктивної токсикології “Reprotox”.
- Deferiprone Uses, Side Effects & Warnings. Інформація з бази даних “Drugs.com”.
- Ferriprox (Deferiprone): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі
- Deferiprone. Інформація з бази даних “Drugs and Lactation Database (LactMed)” – NCBI Bookshelf (nih.gov).
- Teratology and Drugs in Pregnancy. Niebyl, J, Simpson, J, libr. women’s med., (ISSN: 1756-2228)2008; DOI 10.3843/GLOWM.10096.
- Origa R, Comitini F. Pregnancy in Thalassemia. Mediterr J Hematol Infect Dis. 2019 Mar 1;11(1):e2019019. doi: 10.4084/MJHID.2019.019. PMID: 30858957; PMCID: PMC6402552.
- Deferiprone Lipomed, INN-deferiprone: Summary of Product Characteristics. Інформація з сайту Європейського агентства з лікарських засобів “European Medicines Agency”.
- Deferiprone (Oral Route) – Before Using. Інформація з сайту “Mayo Clinic”.
- Deferiprone. Інформація з сайту “ORPHANET – The portal of rare diseases and orphan drugs”.
- Deferiprone Oral: Uses, Side Effects, Interactions, Pictures, Warnings & Dosing. Інформація з сайту WebMD.
- Ferriprox – Deferiprone Tablet. Інформація з сайту “DAILYMED – US National Library of Medicine”.
Адаптовано 20.03.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 20.03.2023 р.
ІНТЕРФЕРОН ГАММА 1b
Назва англійською мовою: interferon gamma-1b.
Група/призначення: імуномодулятори.
Загальна інформація у статті Інтерферони.
Покази: профілактика інфекційних ускладнень у хворих на хронічну гранульоматозну хворобу та уповільнення прогресування злоякісного остеопетрозу.
|
ВАЖЛИВО: відомо про взаємодію інтерферону гамма 1b з 160 лікарськими засобами, 3 станами/захворюваннями (серцеві захворювання, дисфункція центральної нервової системи, мієлосупресія); щодо взаємодії з препаратами, то з 26 вона є вираженою, з 63 – помірною, з 71 – незначною. Перелік препаратів, які взаємодіють з інтерфероном гамма 1b доступний за посиланням Interferon gamma-1b Drug Interactions – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. Значно виражена взаємодія відзначена з наступними препаратами: бупропіон, баріцитиніб, бексаротен, кладрибін, клозапін, деферипрон, фінголімод, йогексол, йопамідол, лефлуномід, ломітапід, левокетоконазол, метризамід, міпомерсен, наталізумаб, озанімод, пексидартиніб, понесімод, самарій (153Sm) лексидронам, сіпонімод, трамадол, терифлуномід, тофацитиніб, упадацитиніб, воклоспорин. |
Альтернативні назви / синоніми: інгарон.
Діюча речовина: інтерферон гамма.
Рекомендації при вагітності:
Допустимий тільки у випадку крайньої необхідності для матері.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Відсутні повідомлення про використання інтерферону гамма 1b у вагітних жінок. Рекомбінантний інтерферон гамма 1b призначається для зниження частоти та вираженності важких інфекцій у пацієнтів з хронічним гранулематозом. Виходячи з таких показів не очікується багато випадків лікування вагітних жінок.
В період вагітності використовувати тільки якщо користь для матері перевищуватиме ризик для плода.
Інформація щодо досліджень на тваринах:
Інтерферону гамма 1b притаманний абортивний ефект у приматів у випадку лікування дозою, яка в 100 разів перевищує терапевтичну. Аналогічну активність спостерігали у мишей, лікованих токсичними для матері дозами. Також у мишей відзначали підвищення частоти маткових кровотеч та зниження виживання новонароджених. Однак, у приматів не виявлено ознак тератогенності на фоні доз, які у 2-100 разів перевищували терапевтичну. Лікування вагітних мишей дозою 5000 Од/добу протягом 6 днів призводило до токсичних гематологічних змін у плодів і матерів. Крім підвищеної частоти абортів та зменшення ваги плодів, у плодів, які вижили спостерігали важкі аномалії – пригнічення або уповільнення формування ока та гематоми головного мозку.
При використанні нижчих доз не спостерігають материнської токсичності, ембріотоксичності, фетотоксичності, тератогенності.
Інформація щодо впливу на плід:
Відсутній досвід застосування у людини.
Застосування препарату під час вигодовування:
Відсутні повідомлення про використання інтерферону гамма 1b в період лактації у людини. Інтерферон гамма є нормальним компонентом грудного молока людини.
Відсутня інформація про використання екзогенного інтерферону гамма 1b в період грудного вигодовування. Відомо, що дуже мала кількість інтерферону альфа та інтерферону бета-1а проникає до грудного молока. Будь-який інфтерферон очевидно руйнується в шлунково-кишковому тракті немовляти та не абсорбується, за винятком, можливо новонароджених. Голдерна пастеризація (до 62,5°C протягом 30 хвилин) зменшує концентрацію ендогенного інтерферону гамма в середньому на 10%.
Вплив на фертильність (чоловіків та жінок):
Не виключено, що високий рівень інтерферону гамма може порушувати фертильність у жінок та чоловіків.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Towers C, Forinash A. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Eleventh edition, 2017, Wolters Kluwer. 1646 pages. ISBN: 978-1-4963-4962-0.
- Інформаційна система Центру репродуктивної токсикології “Reprotox”.
- Interferon gamma-1b Uses, Side Effects & Warnings. Інформація з бази даних “Drugs.com”.
- Interferon Gamma-1b. База даних “Drugs and Lactation Database (LactMed)”.
Адаптовано 17.01.2023 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри факультетської терапії Ужгородського національного університету.
Переглянуто редакційною колегією 17.01.2023 р.
РИВАСТИГМІН
Назва англійською мовою: Rivastigmine.
Група/призначення: інгібітори холінестерази.
Покази: симптоматичне лікування деменції, обумовленої хворобою Альцгеймера деменції, обумовленої хворобою Паркінсона.
|
ВАЖЛИВО: відомо про взаємодію ривастигміну з 317 лікарськими засобами, 5 станами/захворюваннями (брадикардія, бронхоспазм, паркінсонізм, пептичні виразки, судоми); щодо взаємодії з препаратами, то з 10 вона є вираженою, з 293 – помірною, з 14 – незначною. Перелік препаратів, які взаємодіють з дарифенацином доступний за посиланням Rivastigmine Interactions Checker – Drugs.com, де можна ввести назву препарату для перевірки такої взаємодії. Значно виражена взаємодія відзначена з наступними препаратами: бупропіон, йогексол, йопамідол, метризамід, мобоцертиніб, озанімод, пакритиніб, понесімод, сіпонімод, трамадол. |
Альтернативні назви / синоніми: екселон.
Діюча речовина: ривастигмін.
Рекомендації при вагітності:
Допустимий тільки у випадку крайньої необхідності для матері.
Рекомендації при лактації:
Не рекомендований – потенційно токсичний.
Прийом під час вагітності (короткий висновок):
Відсутні повідомлення про використання ривастигміну в період вагітності у людини. Виходячи з показів до призначення такі випадки очікуються нечасто. Дані від експериментальних тварин припускають низький ризик для ембріону/плода. Відомо, що репродуктивні дослідження у тварин не завжди передбачають наслідки для людини, тому препарат слід призначати вагітним тільки у випадку необхідності для матері. Але при випадковому впливі препарату в період вагітності не слід рекомендувати переривання.
Інформація щодо досліджень на тваринах:
Репродуктивні дослідження проводились у щурів та кролів. У щурів дози, що вдвічі перевищували максимальну рекомендовану для людини, виходячи з площі поверхні тіла, не продемонстрували тератогенності. Зменшення ваги плодів/новонароджених спостерігали у щурів на фоні доз, нижчих від максимально рекомендованої для людини, зазвичай, у присутності материнської токсичності. Дози на рівні 0,9 від максимальної рекомендованої для людини не впливали на фертильність чи репродуктивну поведінку. У кролів не відзнаічено тератогенності на фоні 4-кратної максимальній рекомендованій для людини дози. Ривастигмін та/або його метаболіт проникають через плаценту у кролів із середнім співвідношенням між тканинами плода та плацентою на рівні 0,5.
Інформація щодо впливу на плід:
Ривастигмін є зворотним інгібітором холінестерази, має специфічні покази, наведені вище.
Препарат інтенсивно метаболізується до неактивних метаболітів. Рівень зв’язування з білками є помірним – приблизно 40%, період напіввиведення – 1,5 годин.
Невідомо, чи ривастигмін або його метаболіти проникають через плаценту у людини. Молекулярна вага основної сполуки та помірний рівень зв’язування з білками припускають такий трансфер. Дуже короткий період напіввиведення обмежуватиме доступну для ембріону/плода кількість препарату.
Застосування препарату під час вигодовування:
Відсутні повідомлення про використання ривастигміну в період лактації у людини. Специфічні покази свідчать, що такі випадки зустрічатимуться рідко.
Молекулярна вага препарату та помірний рівень зв’язування з білками плазми припускають екскрецію до грудного молока. Проте кількість, доступну для новонародженого обмежуватиме дуже короткий період напіввиведення. Наслідки такого впливу на немовля на грудному вигодовуванні невідомі. У невагітних дорослих найчастішими побічними ефектами є нудота, блювота, анорексія, диспепсія, астенія.
Відомо, що ривастигмін проникає до молока в експериментальних тварин.
Не рекомендований в період лактації.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Towers C, Forinash A. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Eleventh edition, 2017, Wolters Kluwer. 1646 pages. ISBN: 978-1-4963-4962-0.
- Rivastigmine Uses, Side Effects & Warnings. Інформація з бази даних “Drugs.com”.
- Exelon (Rivastigmine Tartrate): Uses, Dosage, Side Effects, Interactions, Warning. Інформація з бази даних “RxList” мережі WebMD.
- What You Should Know About Taking Rivastigmine when pregnant, nursing, or administering to children or adults over 60. Інформація з сайту мережі WebMD.
- Rivastigmine: Summary of Product Characteristics. Інформація з сайту Європейської агенції з лікарських засобів “European Medicines Agency”.