Теропи
АДЕМЕТІОНІН
Група/призначення:
Засоби, що впливають на систему травлення і процеси метаболізму. Гепатопротектори. Амінокислоти та їх похідні. В США та Канаді є харчовою добавкою.
S-аденозил-L-метіонін (адеметіонін) – натуральна амінокислота, присутня практично у всіх тканинах і рідких середовищах організму, це метильована форма метіоніну. Адеметіонін головним чином діє як коензим та донор метильної групи у реакціях трансметилювання, що є необхідним метаболічним процесом у людини та у тварин. Перенесення метильних груп (трансметилювання) також є необхідним метаболічним процесом при будуванні подвійного фосфоліпідного шару в мембранах клітин та сприяє текучості мембран. Адеметіонін здатний проникати через гематоенцефалічний бар’єр. Процес трансметилювання за участі адеметіоніну є ключовим в утворенні нейромедіаторів центральної нервової системи, включаючи катехоламіни (допамін, норадреналін, адреналін), серотонін, мелатонін та гістамін.
Адеметіонін також є попередником в утворенні фізіологічних сульфурованих сполук (цистеїну, таурину, глютатіону, коензиму А та ін.) у реакціях транссульфурування. Глютатіон, найпотужніший антиоксидант у печінці, відіграє важливу роль у печінковій детоксикації. Адеметіонін підвищує рівень печінкового глютатіону у пацієнтів з ураженням печінки як алкогольного, так і неалкогольного ґенезу. Фолієва кислота (фолати) та вітамін В12 є необхідними конутрієнтами у процесах метаболізму та відновлення адеметіоніну.
Альтернативні назви / синоніми:
Гептрал, гепаметіон, S-аденозил-L-метіонін.
Діюча речовина: адеметіонін.
Рекомендації при вагітності: сумісний.
Рекомендації при лактації: сумісний.
Прийом під час вагітності (короткий висновок):
Невідомо, чи додавання препарату під час вагітності несприятливо впливає на її результати. Виходячи з досвіду застосування метіоніну не очікується підвищення ризику.
Інформація щодо досліджень на тваринах:
Культивування ембріонів щурів у 0,05 мМ адеметіоніну не призвело до порушення розвитку. Репродуктивні дослідження проводились з адеметионіну сульфата п–толуолсульфонатом. Дози до 400 мг/кг/день підшкірно або внутрішньовенно у самок та самців щурів не призводили до несприятливого впливу на фертильність чи репродуктивну поведінку. Дози до 40 мг/кг/день, введені внутрішньовенно вагітним кролям та 400 мг/кг/день вагітним щурам не призводили до порушення ембріофетального розвитку у щурів. Також не спостерігали неонатальної токсичності при введенні препарату в період лактації.
Група китайських вчених повідомила, що лікування щурів адеметионіном компенсує деякі несприятливі ефекти впливу свинцю.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Недостатність процесів трансметилювання, включно з тими, де залучений адеметіонін, вважають відповідальними за формування дефектів нервової трубки, які можна попередити додаванням фолієвої кислоти, однак, одночасне призначення вальпроєвої кислоти не зменшує ризику виникнення асоційованих з цим останнім препаратом дефектів нервової трубки.
Адеметіонін призначається при захворюваннях печінки. Cochrane*-аналіз виявив 4 плацебо-контрольовані дослідження, при яких внутрішньовенно вводили адеметіонін з приводу внутрішньопечінкового холестазу. Тільки одне з 4 досліджень виявило покращення стану щодо свербежу, який супроводжує внутрішньопечінковий холестаз. Два дослідження не виявили істотної різниці в частоті передчасних пологів. Одне з досліджень спостерігало за дітьми ще 3 місяці після народження, несприятливих результатів не відзначали.
|
*Cochrane – це глобальна незалежна мережа практикуючих лікарів, дослідників, захисників пацієнтів, яка видає систематично свої аналізи з різних питань. |
Внутрішньопечінковий холестаз вагітних проявляється в ІІ та ІІІ триместрах з раптовим початком важкого шкірного свербежу, який починається на долонях та підошвах і швидко поширюється. Свербіж триває протягом вагітності і погіршується вночі. Вторинне ураження включає лінійні та розідрані папули, що розвиваються внаслідок розчісування. Жовтяниця виникає в приблизно 10% пацієнтів внаслідок внутрішньопечінкового холестазу, часто супроводжується потемнінням сечі і світлим глинистим стільцем. Ці пацієнтки мають ризик розвитку стеатореї з мальабсорбцією жиророзчинних вітамінів, включно з вітаміном К, що може призводити до кровотеч та холелітіазу.
Див. статтю Шкірний свербіж та вагітність.
Застосування препарату під час вигодовування:
Відсутня інформація, метіонін сумісний з грудним вигодовуванням.
Вплив на фертильність (чоловіків та жінок):
Культивування клітин Лейдига щурів у 1,4 мМ розчині адеметіоніну призводило до підвищення рівнів лютеїнізуючого гормону та хоріогонічного гонадотропіну людини і потенціювання синтезу тестостерону. Італійське дослідження використало 800 мг/день адеметіоніну протягом 8 місяців у чоловіків з неплідністю і повідомило про підвищення рухливості сперматозоїдів.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 15.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 15.01.2018 р.
ІЗОМЕТЕПТЕН
Група/призначення: симпатоміметик.
Доступний у складі комбінованих препаратів в комбінації з дихлоралфеназоном (седативний, снодійний препарат) та ацетамінофеном (парацетамол) для лікування артеріальної гіпертензії та мігрені.
Альтернативні назви / синоніми: немає.
Комбіновані препарати: ізоком (іsocom; ацетамінофен, дихлоралфеназон, ізометептен), мідрин (midrin; ацетамінофен, ізометептен), мігратин (migratine; ацетамінофен, дихлоралфеназон, ізометептен).
Діюча речовина: ізометептен.
Рекомендації при вагітності:
Обмежені дані про використання у людини; відсутні дані від експериментальних тварин.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Контрольовані дослідження щодо наслідків пренатального впливу ізометептену не проводились.
Інформація щодо досліджень на тваринах: відсутня інформація.
Інформація щодо впливу на плід:
Досвід застосування при вагітності у людини обмежений.
Спільний перинатальний проект (Collaborative Pеrinatal Project) за період 1958-1965 років виявив 8 випадків впливу ізомепептену в І триместрі серед 96 жінок, які приймали симпатоміметики. У групі 96 жінок в 7 дітей діагностували вроджені вади розвитку (співвідношення шансів 0,96). Автори дійшли висновку про відсутність асоціації між цими препаратами та вродженими вадами.
Два випадки припускають, що ізометептен може відігравати певну роль у виникненні післяпологової церебральної ангіопатії. В одному випадку в Бразилії жінка (без рецепту) приймала ізометептен в комбінації з анальгіном та кофеїном з приводу головного болю через тиждень після пологів. Через 8 тижнів після пологів у жінки виник інтенсивний фронтальний головний біль. МРТ припустило внутрішньомозковий крововилив. Ізометептен відмінили і симптоми зникли. В обох доступних випадках припущено, що симпатоміметичні ефекти препарату відігравали причинну роль.
Застосування препарату під час вигодовування: відсутня інформація.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 11.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 12.01.2018 р.
АНТИПІРИН
Група/призначення:
Анальгетик-антипіретик. Антипірин діє шляхом пригнічення синтезу простагландину. Вагітність впливає на фармакокінетику антипірину у матері, підвищуючи його кліренс та знижуючи період напіввиведення. Антипірин вже не призначається в якості монотерапії, але залишається компонентом очних та вушних крапель і деяких комбінованих препаратів для лікування мігрені, наприклад, дихлоралфеназону, який є проліками* антипірину.
|
*Проліки (англ. prodrugs) — хімічно модифіковані форми продуктів (речовин), які в біосередовищах організму внаслідок метаболічних процесів перетворюються на ліки. |
Альтернативні назви / синоніми:
Феназон, анальгезін, піразолін.
Діюча речовина: антипірин.
Рекомендації при вагітності:
Обмежені дані про використання у людини; відсутні співставні дані від експериментальних тварин.
Рекомендації при лактації:
Відсутні дані про застосування у людини; потенційно токсичний.
Прийом під час вагітності (короткий висновок):
Обмежений досвід застосування у людини при вагітності та відсутність співставних даних від експериментальних тварин не дозволяють адекватно оцінити ембіо-фетальний ризик хлоралгідрату.
Кращою рекомендацією є уникнення призначення антипірину при вагітності через відому токсичність у дорослих (гемолітична анемія, агранулоцитоз), окрім того накопичено значно більше досвіду з іншими анальгетиками-антипіретиками, наприклад ацетамінофеном (парацетамол).
Інформація щодо досліджень на тваринах:
Призначення вагітним вівцям при гіпертермії призводило до метаболічної ацидемії у плода, гіперглікемії, зменшення кровоплину в судинах пуповини. Ці знахідки припускають, що простагландіни можуть відігравати важливу роль у підвищенні температури тіла матері та плоду без спричинення патологічних порушень метаболізму плоду. Призначення вагітним вівцям також асоціюється зі змінами кровоплину у плода. Такі дані слід інтерпретувати з обережністю.
Інформація щодо впливу на плід:
Досвід застосування при вагітності у людини обмежений.
Дослідження, призначене для оцінки токсичності для плода нестероїдних протизапальних препаратів, визначило пік концентрації антипірину в плазмі плода на рівні 0,75 від материнського показника, виходячи з даних отриманих від тварин та людини.
Спільний перинатальний проект (Collaborative Pеrinatal Project), моніторуючи 50282 пари мати-дитина, ідентифікував 27 жінок з впливом ненаркотичних анальгетиків в І триместрі, з них 8 приймали антипірин (в основному перорально). В цій групі з 27 пар мати-дитина виявлено 1 вроджену ваду розвитку (співвідношення шансів 0,46), проте невідомо який саме препарат приймала жінка.
Подвійне сліпе рандомізоване дослідження щодо профілактики неонатальної жовтяниці порівнювало вплив антипірину (N=24) в дозі 300 мг/день з плацебо (N=24) з 38 тижня вагітності до пологів. Середня тривалість лікування в обох групах становила 15,5 днів. Середня концентрація білірубіну у немовлят на 4 день життя становила 62,6 мкмол/л в групі антипірину в порівнянні з 111,5 мкмол/л в групі плацебо (р<0,005). На думку авторів зниження рівня білірубіну пов’язане з індукцією глюкуронілтрансферази в печінці плода, що є відомим ефектом антипірину. У новонароджених не спостерігали несприятливих наслідків.
Застосування препарату під час вигодовування:
Дослідження у кролів продемонструвало трансфер антипірину до грудного молока, співвідношення молоко : плазма становило 1,0.
При дослідженні у 1982 році антипірин призначили 7 жінкам в період лактації в терміні 2-19 місяців після пологів. Кожна жінка прийняла одноразово перорально 18 мг/кг антипірину в розчині. Двом жінкам визначали рівень антипірину кожні 10 хвилин протягом першої години, пік зареєстрували через 10 хвилин після дози як в грудному молоці, так і в слині. Період напівиведення в молоці становить в середньому 11,6 годин (5,7-21,7 годин). Підраховано, що немовля на виключно грудному вигодовуванні отримає 6,4 мг антипірину або 0,59% материнської дози.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 11.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 12.01.2018 р.
ТРИХЛОРЕТИЛЕН
Група/призначення:
Це хімічна сполука (C2HCl3), що належить до класу хлорованих вуглеводнів. Під торговою маркою Трімар та Трилен, трихлороетилен використовується як інгаляційний анестетик та анальгетик. Це потужний наркотичний засіб для інгаляційного наркозу (в основному для короткострокового за допомогою наркозних апаратів).
Широко використовується в промисловості як розчинник. За номенклатурою IPAC (Міжнародний союз фундаментальної та прикладної хімії; International Union of Pure and Applied Chemistry) назва сполуки — трихлоретен. Абревіатури, які часто використовуються в промисловості: ТХЕ, трихлор.
Також розцінюється як забруднювач питної води.
Альтернативні назви / синоніми: трімар, трилен.
Діюча речовина: трихлоретилен.
Рекомендації при вагітності:
Вплив на людину через забруднену питну воду; ризик не підвищений.
Рекомендації при лактації:
Відсутня інформація, проникає в грудне молоко із забрудненої води.
Прийом під час вагітності (короткий висновок):
Більшість експериментальних досліджень у ссавців не виявили підвищення частоти вроджених вад розвитку при впливі трихлоретилену. Група дослідників при тестуванні у щурів, а потім при дослідженні у людини ідентифікувала асоціацію препарату з вродженими вадами серця. Ці дослідження піддали критиці через методологію. Інші дослідження у людини не виявляли підвищення частоти вроджених вад розвитку.
Трихлоретилен проникає через плаценту в багатьох видів тварин. Так, у мишей інгаляційне введення препарату призводить до акумуляції його метаболітів, особливо, трихлороцтової кислоти, в амніотичній рідині.
Інформація щодо досліджень на тваринах:
Вплив препарату на курячі яйця призводив до загибелі ембріонів, порушення росту, мальформацій в ембріонів, які вижили. Одне з таких досліджень було спрямоване на виявлення кардіальних вад. Повідомили про підвищення вад серця, хоча частота не була залежною від дози. Доступні 9 повідомлень про серцеві вади у лікованих трихлоретиленом курячих ембріонів. Запропоновано можливий механізм цього явища: рання експресія детоксикаційних ферментів в тканині серця курячих ембріонів.
Інгаляційний вплив трихлоретилену на вагітних щурів та мишей в дозі 300 ppm (частин на мільйон, parts per million) протягом 7 годин на день на 6-15 гестаційні дні призводив до невеликого зменшення ваги матерів. Не спостерігали несприятливого впливу на вагу та виживання плодів і підвищення ризику вроджених вад розвитку. При введенні інгаляційно вагітним щурам 1800 ppm 6 годин/день 5 днів/тиждень протягом 2 тижнів до парування або 6 годин/день на 1-21 гестаційні дні, або і при матуванні, і при вагітності не відзначали істотного впливу на результати, за винятком затримки осифікації, що є радше ознакою затримки розвитку, аніж мальформацій. Також не відзначали істотного впливу на поведінку тварин. Введення трихлоретилену щурам та кролям інгаляційно в дозі 500 ppm 6-7 годин/день протягом більшої частини вагітності не підвищувало рівня материнської та фетальної токсичності та частоти вроджених вад розвитку. В 4 кроликів була гідроцефалія. Введення щурам інгаляційно 100 ppm на 8-21-й гестаційні дні призводило до зменшення розміру плодів та затримки оссифікації відповідно до затримки розвитку, але не було підвищення частоти вроджених вад. При впливі на вагітних щурів дози до 600 ppm 6 годин/день 7 днів на тиждень не відзначали несприятливих результатів, незважаючи на материнську токсичність на фоні високих доз. Введення вагітним щурам через шлунковий зонд дози 10, 100 або 1000 мг/кг/день перед та під час вагітності продемонструвало зменшення набирання ваги матерями та зменшення виживання плодів на фоні високих доз. На думку авторів зменшення виживання плодів спричинялось материнською токсичністю. Вроджених вад розвитку не спостерігали.
Лікування вагітних мишей протягом 5 днів дозами до 240 мг/кг/день не продемонструвало несприятливого впливу на вагу плодів або наявності зовнішніх (видимих) вад. При дослідженні від національної токсикологічної програми (National Toxicology Program) щурам та мишам з харчуванням вводили трихлоретилен 0,15, 0,30 або 0,60% в період парування та при вагітності. Результативна доза у мишей становила 100, 300 та 700 мг/кг/день, а у щурів – 76, 156 та 289 мг/кг/день. На фоні найвищих доз спостерігали несприятливий вплив на вагу тварин та зменшення кількості новонароджених щурів. Рівень смертності після народження не змінювався, вроджені вади розвитку не наводяться. Введення вагітним щурам через шлунковий зонд дози 1125 або 1500 мг/кг/день на 6-19 гестаційні дні продемонструвало зниження ваги матерів або набирання ваги матерями та зменшення виживання ембріонів. У деяких новонароджених тварин спостерігали недорозвиток очей. При моделюванні забруднення водопровідної води хімічними речовинами дослідники вводили вагітним мишам суміш трихлоретилену з іншими сполуками в концентрації, в 3000 разів вищій за показник в питній воді. При цьому не спостерігали підвищення частоти несприятливих результатів вагітностей, включно з вродженими вадами розвитку. На противагу цим даним дослідники з арізонського університету опублікували результати лікування вагітних щурів трихлоретиленом, які продемонстрували підвищення частоти вад серця в потомства. Два з цих досліджень не використовували доречного статистичного аналізу, а третє аналізувало випадки лікування тварин в різний час, як згодом виявилось. Така невідповідність знахідок наводить на думку про недостовірність висновків. Крім того, дослідження іншої групи, до якої входив один з аризонських дослідників для оцінки зразків, не підтвердило підвищення частоти вроджених вад серця у щурів при пренатальному впливі дози 500 мг/кг/день через шлунковий зонд. Наступний аналіз цих дослідників та інші повідомлення не виявили асоціації між пренатальним впливом трихлоретилену та вродженими вадами очей у щурів.
Група вчених повідомила, що пренатальний вплив трихлоретилену може порушувати дозрівання легень у мишей, ймовірно, через пригнічення активності фосфоліпази А2, ферменту, залученого в процес синтезу сурфактанту. Щуренята з пренатальним впливом трихлоретилену демонстрували істотне порушення пошукової та локомоторної активності після народження. Дослідження у мишей та щурів припустили, що мієлінація мозку чи інші процеси дозрівання можуть пригнічуватись пренатальним впливом трихлоретирену.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
У 1990 році вчені університету штату Арізони повідомили про асоціацію між вродженими вадами серця та впливом забрудненої води в південно-західному Тусоні. Це питання підняли педіатри, оскільки серед пацієнтів з вадами серця переважали жителі цього міста. Дослідження оцінювало місце проживання та роботи батьків дітей. Виходячи з даних перепису населення визначили, що вроджені вади серця діагностували у дітей 0,0068% жінок, які проживали в І триместрі вагітності на забрудненій території в порівнянні з 0,00264% жінок, які не проживали на забрудненій території – статистично значима різниця. Автори не змогли адекватно врахувати вищу частку жителів забрудненої території іспанського походження. Крім того, інші дослідники в штаті Арізона вважали, що такі результати є недійсними через помилки в класифікації впливу агенту та неможливості адаптації до інших факторів ризику вроджених аномалій. Ці вчені опублікували карту забрудненої території в Тусоні, яка відрізнялась від створеної університетськими дослідниками. Рев’ю 2006 року дійшло висновку про непереконливість асоціації між трихлоретиленом та вродженими вадами серця.
Одне з досліджень вивчало промисловий вплив трихлоретилену на самовільне переривання вагітностей. Хоча автори дійшли висновку про асоціацію між спонтанними абортами та впливом аліфатичних вуглеводів, такого зв’язку не виявлено для трихлоретилену. Інший аналіз самовільного переривання не продемонстрував істотної асоціації з впливом трихлоретилену, але не скориговані дані свідчать про зв’язок між сполукою та викиднями, коли не враховували тривіальний вплив або коли враховували контакт через шкіру. Кількість вагітностей з впливом трихлоретилену була недостатньою для адекватного аналізу.
Дослідження випадок-контроль, яке вивчало орофаціальні розщілини на основі інформації про посади та місце роботи для оцінки хімічного впливу на вагітну, повідомило про асоціацію з трихлоретиленом, виходячи з тільки двох випадків, тому ці знахідки не є статистично значимими.
Дослідження забруднення питної води та несприятливих результатів вагітності дійшло висновку, виходячи з 50% та 90% довірчих інтервалів, а не звичайного 95% довірчого інтервалу, про можливу асоціацію трихлоретилену з дефектами нервової трубки та орофаціальними розщілинами.
Дослідження на основі свідоцтв про народження в Арізоні не виявило істотної асоціації між низькою вагою новонароджених та впливом трихлоретилену, хоча автори дійшли висновку про асоціацію між вагою, нижчою за 1500 грам та таким впливом.
Дослідження 2001 року інформує про зв’язок між вагою новонароджених та забрудненою водою на базі морської піхоти «Кемп Лежен». Первинним забруднювачем був тетрахлоретилен (перхлороетилен), трихлоретилен також був присутнім. Асоціацію з вагою новонароджених виявили тільки у немовлят чоловічої статі та використали 90% довірчий інтервал замість звичного 95%.
Аналіз 2014 року, використавши раніше недоступні дані, повторно розглянув асоціацію трихлоретилену з передчасними пологами, малістю для гестаціного віку, низькою вагою новонароджених, середнім дефіцитом ваги. При впливі найвищих доз трихлоретилену (90 перцентиль на вищих) протягом всієї вагітності виявили асоціації для малості для гестаційного віку (співвідношення шансів 1,5, 95% ДІ ,2-1,9) та низької ваги доношених новонароджених (1,3, 95% ДІ 0,08-2,2).
Дослідження випадок-контроль серед дітей з лейкемією у Вобурні (Массачусетс) було використано для оцінки групи з лейкемією. Всього виявлено 21 дитину з лейкемією в період 1969-1986 років. У 1979 році закрили два громадські джерела водопостачання після виявлення їхнього забруднення миш’яком, трихлоретиленом, тетрахлоретиленом, хлороформом, іншими чинниками. Дослідження випадок-контроль порівнювало дітей з лейкемією з дітьми контрольної групи (без лейкемії) з ціллю оцінити пренатальний вплив забрудненої водопровідної води. Розрахунки базувались на комп’ютерній моделі розподілу води до будинків у Вобурні. Дослідження не продемонструвало статистично значимої асоціації між виявленим впливом забрудненої води та лейкемією дитячого віку, однак, оскільки асоціація була близька до статистично достовірної та через виявлення статистично значимого тренду, автори дійшли висновку про наявність асоціації між пренатальним впливом забрудненої води та лейкемією дитячого віку. Це дослідження не показало причинного зв’язку між пренатальним впливом трихлоретилену та лейкемією дитячого віку, оскільки аналізувалось забруднення сумішшю хімічних препаратів разом. На результат також могли вплинути випадкові або супутні фактори. Так, виявлено статистично істотну асоціацію між грудним вигодовуванням та дитячою лейкемією – в 10 разів вища частота грудного вигодовування, ніж в групі дітей без лейкемії. Інше джерело повідомляє не опубліковані результати вагітностей у Вобурні, які свідчать про зв’язок між впливом забрудненої трихлоретиленом води та низькою вагою новонароджених, проте він не був статистично значимим. Це джерело також повідомляє про підвищення частоти загибелі плодів, малості для гестаційного віку, дефектів очей, атрезії хоан, дефектів нервової трубки, розщілини губи, гіпоспадії. Але у висновку автори стверджують, що отримано замало доказів про несприятливий вплив трихлоретилену на поширеність вроджених вад розвитку у Вобурні.
Повідомлення 2012 року інформує про результати вагітностей в сусідній північній частині штату Нью-Йорк з підвищеною концентрацією трихлоретилену в кімнатному повітрі в порівнянні з показниками штату Нью-Йорк без самого міста Нью-Йорку. Співвідношення шансів було істотно підвищеним для низької ваги (136, 95% ДІ 1,07-1,73; N=76), малості для гестаційного віку (1,23, 95% ДІ 1,03-1,48; N = 117), ваги доношених новонароджених (1,68, 95% ДІ 1,20-2,34; N = 37), кардіальних вад (25, 95% ДІ 1,27-3,62; N = 15), конотрункальних* вад (4,91, 95% ДІ 1,58-15,24; N = 3). Автори зазначають обмеження даного дослідження: на вагу новонароджених також впливають соціально-економічні фактори. Вплив препаратів оцінювався за місцем проживання, а не за моніторингом пренатального впливу, не проводилась корекція на паління серед матерів.
|
*Конотрункальні вади серця («сині»); конотрункус (конусоподібний тракт) – це ділянка серця, яка знизу сполучається з камерами серця, а зверху – з артеріальними судинами. Патологія конотрункуса: загальна артеріальна протока, тетрада Фалло, подвійний вихід правого шлуночка, транспозиція магістральних судин, дисплазія клапанів (стеноз, атрезія, багато стулкові клапани). |
Інше повідомлення інформувало про підвищений ризик вроджених вад серця у дітей жінок, які проживали за 1,32 милі від забрудненої трихлоретиленом місцевості, якщо мама була віком 38 років та старшою. Не виявлено істотної асоціації між відстанню до забрудненої території вродженими вадами серця у матерів всіх вікових груп. Ці результати не є достовірними, оскільки оцінка впливу не була точною, а такі критерії як відстань (1,32 милі) та вік (38 років) аналізували вже після отримання даних.
Застосування препарату під час вигодовування:
Трихлоретилен визначався в грудному молоці жінок в місті Ногалес, Арізона. Ймовірним джерелом сполуки була побутова вода. Трихлоретилен виявлявся в молоці в концентрації до 6 нг/мл і ця концентрація корелювала з аналогічним показником в побутовій воді.
Вплив на фертильність (чоловіків та жінок):
Показники фертильності в експериментальних тварин.
Вплив на мишей та щурів, що проживали разом, дози до 6000 ppm з харчуванням (підраховано прийом до 700 мг/кг/день мишами та 289 мг/кг/день щурами) призвів до токсичності в дорослих тварин на фоні найвищих доз зі зниженням рухливості сперматозоїдів у мишей та невеликого зменшення ваги яєчок в обох видів тварин. У щурів народжувалось менше потомства, чого не спостерігали у мишей. У самок мишей з впливом протягом 2 тижнів дози 0,45% з питною водою формувались ооцити в кількості, аналогічній в контрольній групі, однак менша кількість ооцитів була запліднена in vitro (46% проти 57% в контрольній групі).
Китайське повідомлення інформує про залежне від концентрації зниження рухливості сперматозоїдів та відмінності в апоптозі у самців щурів через 4 години після впливу in vitro дози 4 мМ та вищої. Ці концентрації у приблизно 1000 разів перевищують отримувану в спермі чоловіків після впливу трихлоретилену.
Інгаляційний вплив на мишей дози 1000 ppm протягом 19 днів призводив до гістологічного ураження придатків яєчок, чого не відбувалось з яєчками. Інгаляційний вплив дози 150 ppm протягом 34 днів не впливав на рівень тестостерону в сироватці мишей. Інгаляційне введення самцям мишей дози 0,2% (2000 ppm; знеболювальна концентрація) 4 години на день протягом 5 днів підвищувало відсоток аномальних сперматозоїдів з 1,42 в контрольній групі до 2,43 в групі з впливом трихлоретилену. В групі тварин з впливом дози 0,02% таких змін не спостерігали. Клінічне значення таких знахідок невідоме. Вплив трихлоретилену на мишей в дозі 1000 ppm 6 годин на день 5 днів викликав порушення зв’язування сперматозоїдів з zona pellucida та запліднення in vitro через 2 та 6 тижнів впливу, але такого не спостерігали через 4 тижні після впливу трихлоретилену. Пероральне лікування щурів дозами до 1000 мг/кг/день протягом 6 тижнів порушувало копулятивну здатність внаслідок некрозу, але параметри сперми не змінювались.
Показники фертильності у людини.
Трихлоретилен та його метаболіти визначаються в спермі чоловіків, хоча клінічне значення таких знахідок невідоме. Повідомляється про 15 чоловіків з професійним впливом сполуки без зміни кількості та морфології сперми в порівнянні з контрольною групою. Інше дослідження серед працівників виявило нормальну кількість та рухливість сперматозоїдів у чоловіків з впливом трихлоретилену, однак тільки в 69% морфологія була нормальною. Контрольна група при цьому не залучалася. У чоловіків з виявленим трихлоретиленом у сечі показники спермограми не порушувались.
Оцінка професійного впливу хімічних сполук на чоловіків у Фінляндії не продемонструвала асоціації зі спонтанними абортами у жінок цих працівників.
Рев’ю 2006 року щодо ймовірного впливу на репродукцію трихлоретилену дійшло висновку, що рівні, нижчі за ті, що призводять до системної токсичності, як видається, не чинять несприятливого впливу на фертильність у чоловіків.
Японські вчені повідомили про 20-річну жінку з впливом парів трихлоретилену в концентрації, достатній для втрати свідомості на 2 години. Це призвело до виражених неврологічних симптомів та кількох місяців аменореї. Через рік менструації були нерегулярними та були присутні інші ознаки пригнічення овуляції.
Інше дослідження повідомило про імпотенцію та гінекомастію після тривалого виробничого впливу трихлоретилену на чоловіка.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 09.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 10.01.2018 р.
ДИХЛОРАЛФЕНАЗОН
Група/призначення:
Седативний, снодійний препарат. Дихлоралфеназон є проліками*, сумішшю антипірину (феназон; анальгетик-антипіретик) з хлоралгідратом (седативний, снодійний засіб) або хлоралбетаїном, тому він дисоцієються до цих сполук. Дихлоралфеназон є компонентом препарату, який також містить ізометептен та ацетамінофен (парацетамол; анальгетик-антипіретик); (цей комбінований препарат вилучений з фармацевтичного ринку США з січня 2011 року). Активні метаболіти дихлоралфеназону включають антипірин та трихлоретанол (анестетик). Хлоралбетаїн в організмі людини метаболізується до хлоралгідрату, який потім конвертується до трихлоретанолу.
|
*Проліки (англ. prodrugs) — хімічно модифіковані форми продуктів (речовин), які в біосередовищах організму внаслідок метаболічних процесів перетворюються на ліки. |
Альтернативні назви / синоніми: немає.
Діюча речовина: дихлоралфеназон.
Рекомендації при вагітності:
Обмежені дані про використання у людини; ймовірно сумісний.
Рекомендації при лактації:
Обмежені дані про застосування у людини; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Досвід застосування при вагітності у людини обмежений. Відсутність токсичного впливу на розвиток в одного виду тварин та відсутність повідомлень про ембріо/фетальну токсичність у людини припускають, що ризик, якщо він існує, є низьким.
Інформація щодо досліджень на тваринах:
Тестування у щурів проводились при двох дослідженнях. Дози 50-500 мг/кг/день вводились тваринам з харчуванням, при цьому не спостерігали тератогенних або інших несприятливих наслідків.
Інформація щодо впливу на плід:
Досвід застосування при вагітності у людини обмежений.
Хоча відсутні опубліковані повідомлення про використання дихлоралфеназону при вагітності у людини, одне джерело інформує про «широке використання» цього препарату при вагітності.
Спільний перинатальний проект (Collaborative Pеrinatal Project), моніторуючи 50282 пари мати-дитина, ідентифікував 71 випадок впливу хлоралгідрату в І триместрі. В цій групі виявлено 8 немовлят з вродженими вадами розвитку (співвідношення шансів 1,68). Більше того, коли хлоралгідрат комбінували з усіма транквілізаторами та не барбітуратовими седативними препаратами, не виявили асоціації з вродженими вадами розвитку (1,13; 95% ДІ 0,88-1,44). Щодо впливу хлоралгідрату в будь-якому терміні вагітності: ідентифіковано 358 випадків, з них у 9 – вроджені вади розвитку (0,98; 95% ДІ 0,45-1,84).
Застосування препарату під час вигодовування:
Дихлоралфеназон є проліками суміші хлоралгідрату та антипірину. Трихлоретанол, активний метаболіт хлоралгідрату, проникає в грудне молоко, як і антипірин.
Повідомляється про помірну сонливість у немовляти на грудному вигодовуванні, чия мама приймала щовечора 1300 мг дихлоралфеназону. Жінка також отримувала хлорпромазину 100 мг (антипсихотичний препарат) тричі на день. Дихлоралфеназол метаболізується до трихлоретанолу – активного метаболіту хлоралгідрату. Рівень трихлоретанолу в грудному молоці становив 60-80% від показника в сироватці матері. Через 20 годин метаболіт вже не визначався в сироватці дитини. Розвиток немовляти був нормальним під час впливу препаратів та при спостереженні ще протягом 3 місяців після припинення лікування. Це дослідження не визначало концентрації антипірину в грудному молоці.
Американська академія педіатрії вважає хлоралгідрат сумісним з грудним вигодовуванням.
Вплив на фертильність (чоловіків та жінок):
Відсутня інформація, див. статті Хлоралгідрат та Антипірин.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 09.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 10.01.2018 р.
ХЛОРАЛГІДРАТ
Група/призначення:
Седативний, снодійний препарат.
Альтернативні назви / синоніми:
Ноктек, аквахлорал, суппретт.
Діюча речовина: хлоралгідрат.
Рекомендації при вагітності:
Обмежені дані про використання у людини: відсутні співставні дані від експериментальних тварин.
Рекомендації при лактації:
Обмежені дані про застосування у людини: ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Обмежений досвід застосування у людини при вагітності та відсутність співставних даних від експериментальних тварин не дозволяють адекватно оцінити ембіо-фетальний ризик хлоралгідрату. Проте, виходячи з таких обмежених даних не очікується підвищення частоти вроджених вад розвитку при пренатальному впливі препарату.
Інформація щодо досліджень на тваринах:
Лікування вагітних мишей та щурів 1-5-кратними дозами для людини не призводило до підвищення частоти великих зовнішніх вроджених вад (видимих при огляді) та серцево-судинних вад. Повідомляють про випадок втрати двоплідної вагітності у коня після анестезії хлоралгідратом.
Інформація щодо впливу на плід:
Досвід застосування при вагітності у людини обмежений.
Хлоралгідрат є метаболітом трихлоретанолу. Хлоралгідрат відсутній на фармацевтичному ринку США. Вплив на шкіру може виникати через воду під час прийому душу або плавання в басейні. У 2009 році німецькі дослідники повідомили про використання хлоралгідрату в комбінації з клонідином (антигіпертензивний засіб) для лікування неонатальної абстиненції.
Відсутня інформація про зв’язок між використанням хлоралгідрату та вродженими вадами розвитку. Препарат вводиться в пологах і виявляється в пуповинній крові в концентрації на рівні материнської. Седативні наслідки у немовлят не вивчались.
Спільний перинатальний проект (Collaborative Pеrinatal Project), моніторуючи 50282 пари мати-дитина, ідентифікував 71 випадок впливу хлоралгідрату в І триместрі. В цій групі виявлено 8 немовлят з вродженими вадами розвитку (співвідношення шансів 1,68). Більше того, коли хлоралгідрат комбінували з усіма транквілізаторами та не барбітуратовими седативними препаратами не виявили асоціації з вродженими вадами розвитку (1,13; 95% ДІ 0,88-1,44). Щодо впливу хлоралгідрату в будь-якому терміні вагітності: ідентифіковано 358 випадків, з них у 9 – вроджені вади розвитку (0,98; 95% ДІ 0,45-1,84).
Тривале введення новонародженим седативних доз хлоралгідрату може підвищити ймовірність виникнення гіпербілірубінемії.
Застосування препарату під час вигодовування:
Хлоралгідрат та його активний метаболіт проникають до грудного молока. Пік концентрації – близько 8 мкг/мл – досягається через 45 хвилин після введення ректально дози 1,3 грами. Через 10 годин виявляється тільки слідова концентрація.
Повідомляється про помірну сонливість у немовляти на грудному вигодовуванні, чия мама приймала щовечора 1300 мг дихлоралфеназону. Жінка також отримувала хлорпромазину 100 мг (антипсихотичний препарат) тричі на день. Дихлоралфеназол метаболізується до трихлоретанолу – активного метаболіту хлоралгідрату. Рівень трихлоретанолу в грудному молоці становив 60-80% від показника в сироватці матері. Розвиток немовляти був нормальним під час впливу препаратів та при спостереженні ще протягом 3 місяців після припинення лікування.
Американська академія педіатрії вважає хлоралгідрат сумісним з грудним вигодовуванням.
Вплив на фертильність (чоловіків та жінок):
Вплив на самців мишей трихлоретилену (засіб для інгаляційного наркозу) шляхом інгаляції 100 ppm (частин на мільйон, parts per million) (5,37 мг/л) протягом 1-6 тижнів призводив до продукції сперматозоїдів, які запліднювали на 50% менше яйцеклітин після 2-тижневого впливу. Трихлоретилен в дозах до 100 мг/л не впливав на зв’язування сперматозоїдів з zona pellucida, але рівень зв’язування знижувався при впливі хлоралгідрату in vitro. Це припускає, що метаболіт хлоралгідрату є відповідальним за несприятливий вплив трихлоретилену на фертильність самців.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 03.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 04.01.2018 р.
ХЕНОДІОЛ
Група/призначення:
Препарати, які гальмують утворення жовчних конкрементів та полегшують їх виведення з жовчю. Здатність хенодіолу розчиняти жовчні камені пов’язана зі зменшенням утворення холестерину шляхом пригнічення (придушення активності) мікросомального ферменту, що приймає участь в синтезі холестерину.
Альтернативні назви / синоніми:
Хенікс, хенодезоксихолева кислота.
Діюча речовина: хенодезоксихолева кислота.
Рекомендації при вагітності: протипоказаний.
Рекомендації при лактації:
Відсутні дані про застосування у людини; потенційно токсичний.
Прийом під час вагітності (короткий висновок):
Препарат протипоказаний при вагітності через гепатотоксичність.
Інформація щодо досліджень на тваринах:
Тератогенні дослідження були негативними у мишей, щурів, кролів, хом’яків, бабуїнів. Препарат продемонстрував гепатотоксичність у плодів гризунів та приматів при пренатальному лікуванні. Також відзначали ураження наднирників (великий некроз) та нирок (інтерсиціальні крововиливи) у плодів макак-резус. Теоретично гепатотоксичність хенодіолу у тварин головним чином обумовлена його головним бактеріальним метаболітом – літохолевою кислотою (утворюється в кишечнику під впливом мікрофлори). На відміну від людей, які швидко метаболізують літохолеву кислоту до нетоксичних сполук, що погано абсорбуються, тварини (кролі, макаки-резус, бабуїни) нездатні утворювати сульфатні кон’югати в повній мірі для детоксикації метаболіту і тому є сприйнятними до впливу на печінку.
Одне дослідження дійшло висновку, що дигідрокси жовчні кислоти, такі як хенодіол, проникають, принаймні, у щурів, від матері до плода. Гепатотоксичність у щурів була залежною від дози, тому, ймовірно, існує безпечна доза.
Інформація щодо впливу на плід:
Відсутній досвід застосування у людини при вагітності.
Хенодезоксихолева кислота – це природна жовчна кислота, одна з двох найважливіших жовчних кислот для людини (інша – холева), які належать до первинних жовчних кислот, що утворюються в гепатоцитах при окисленні холестерину. В жовчному міхурі присутня головним чином у вигляді кон’югатів з гліцином та таурином.
Оскільки досвід застосування при вагітності відсутній, невідомою є безпечна для вагітних доза хенодіолу.
Застосування препарату під час вигодовування:
Відсутня інформація про застосування в період лактації у людини.
Хоча хенодезоксихолева кислота є нормальним компонентом грудного молока людини, відсутня інформація про вплив на немовля в період вигодовування. Доступні дані недостатні для визначення наявності зв’язку цієї сполуки та частотою жовтяниці.
Вплив на фертильність (чоловіків та жінок):
Відсутня інформація. Обмежене тестування у щурів не продемонструвало несприятливого впливу на фертильність самок та самців.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 02.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.01.2018 р.
ШКІРНИЙ СВЕРБІЖ ТА ВАГІТНІСТЬ
Назва англійською мовою: Dermatoses of pregnancy, Skin itching
Комплексні ендокринологічні, імунологічні, метаболічні та судинні зміни, пов’язані з вагітністю, можуть впливати на шкіру з різними проявами.
| Ураження шкіри під час вагітності можна грубо класифікувати як фізіологічні зміни шкіри, зміни, пов’язані з попередніми існуючими захворюваннями шкіри та специфічні дерматози вагітності, при яких свербіж є основним симптомом. Фізіологічні зміни шкіри під час вагітності включають зміни пігментації, зміни сполучної тканини, судинної системи та ендокринної функції, а також зміни з боку волосся та нігтів. Як відомо, вагітність впливає на перебіг існуючих захворювань шкіри як позитивним, так і негативним чином. Типовим прикладом є псоріаз – класичне Th1-асоційоване захворювання, яке часто покращується під час вагітності, а погіршується після пологів |
| Свербіж присутній приблизно в 20% вагітних. Це може впливати на сон та якість життя, також може погіршувати депресію. Важливо, щоб лікарі були знайомі з цими станами для вироблення тактики лікування, оскільки деякі захворювання потребують мультидисциплінарної команди, яка включає акушера-гінеколога, дерматолога, сімейного лікаря, гастроентеролога |
|
Асоційовані з вагітністю стани згідно з класифікацією Ambros-Rudolph із співавторами:
Ці стани асоціюються з вираженим свербежем, а деякі – з несприятливими результатами вагітностей. Клінічна історія та фізичний огляд є найважливішими діагностичними підказками при оцінці свербіння під час вагітності. |
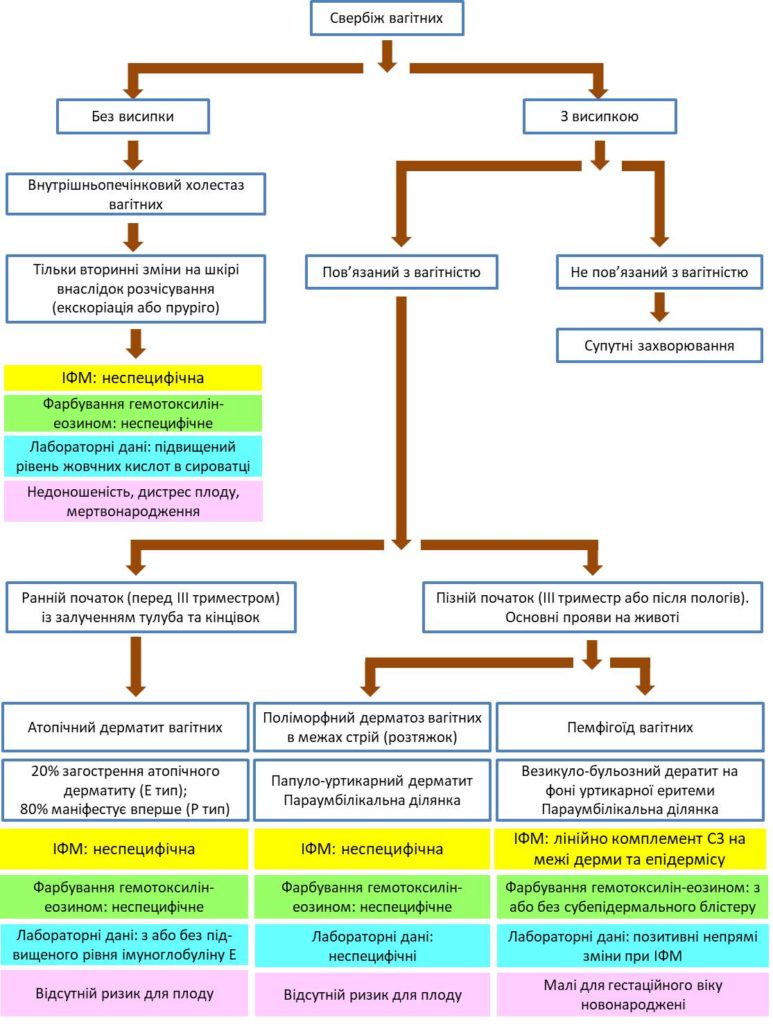
Діагностичні підходи до свербежу при вагітності наводяться в діаграмі в кінці статті.
Альтернативні назви / синоніми:
Свербіж при вагітності, свербіння та вагітність, свербіння при вагітності, дерматоз вагітних, дерматит вагітних, пемфігоїд вагітних, внутрішньопечінковий холестаз вагітних, атопічний дерматит вагітних, поліморфний дерматоз вагітних, шкірні зміни при вагітності, дерматологічні зміни при вагітності.
Свербіж під час вагітності (короткий висновок):
Свербіж при вагітності вимагає врахування анамнезу та проведення повного обстеження (огляду). Лабораторні дослідження включають визначення рівнів печінкових трансаміназ, жовчних кислот, в певних випадках біопсію шкіри для постановки точного діагнозу. Шкірні зміни (дерматози вагітних) необхідно враховувати для диференціального діагнозу свербежу і, відповідно, контролювати. Такі випадки потребують точного діагнозу, оскільки частина з них асоціюється з несприятливими наслідками для плодів.
Описане для окремих випадків лікування та подане в підсумку вважається безпечним при вагітності.
Інформація щодо впливу на плід та вагітну:
Дерматози, асоційовані з вагітністю
Поліморфний дерматоз вагітних (polymorphic eruption of pregnancy).
Синоніми (попередні назви): сверблячі уртикарні папули та бляшки вагітних (pruritic urticarial papules and plaques of pregnancy (PUPPP), токсемічна висипка вагітних (toxaemic rash of pregnancy), токсична еритема вагітних (toxic erythema of pregnancy), пруріго (почесуха) вагітних з пізнім початком (late-onset prurigo of pregnancy).
Це доброякісні обмежені запальні процеси на шкірі. Частота поліморфного дерматозу вагітних становить 1 на 160 вагітностей. Більшість випадків виникає при першій вагітності в ІІІ триместрі або одразу після пологів (15%). Цей стан асоціюється з прискореним набиранням ваги жінками, також частіше спостерігається при багатоплідних вагітностях і рідко повторюється при наступних вагітностях.
Клінічні прояви.
Типовими змінами при поліморфному дерматозі вагітних є уртикарні папули, які зливаються в бляшки і поширюються від живота до сідниць і стегон. В 50% ураження розвиваються у вигляді мікропухирців. Ураження починається з живота, як правило, в межах стрій (розтяжок) і в типових випадках не поширюється на навколопупкову ділянку, долоні, підошви, обличчя. Збереження інтактною навколопупкової області допомагає віддиференціювати поліморфний дерматоз вагітних від пемфігоїду вагітних на ранніх стадіях. Спочатку свербить шкіра в області стрій, далі з’являється еритема і, нарешті, кропив’янка. Пізніше морфологія стає більш поліморфною: везикули (1-2 мм в діаметрі; ніколи не має булл), поширена не уртикарна еритема, таргетоїдні та екзематозні ураження розвиваються в половини пацієнтів. Висипка, як правило, проходить за 4-6 тижнів, незалежно від пологів. Пацієнтки дуже не комфортно почувають себе, часто свербіж порушує сон.
Діагностика.
На початку поліморфний дерматоз вагітних можна сплутати з пемфігоїдом вагітних, однак, вилучення з процесу навколопупкової ділянки дозволяє уточнити діагноз. Іншими станами, які можна сплутати з поліморфним дерматозом вагітних є атопічний дерматит та контактний дерматит. Для діагнозу необхідний ретельний анамнез та медичний огляд, оскільки відсутні системні зміни. Результати лабораторних досліджень, включно з гістологією, серологією, імунофлуорисценцією є не специфічними.
Лікування.
Сверблячі уртикарні папули та бляшки вагітних є обмеженими змінами на шкірі без серйозних наслідків для матері та плода. Середня тривалість висипки становить 6 тижнів і зникає за кілька днів після пологів. Частіше виникає при першій вагітності і рідко повторюється, за винятком наступних багатоплідних вагітностей. Основним лікуванням є призначення помірних та сильніших топічних кортикостероїдів і антигістамінних препаратів. Полегшення наступає в межах 24-72 годин. Також допомагають масляні ванни та емолієнти (спеціальні засоби для догляду за шкірою, які в присутності води або без неї утворюють на поверхні шкіри мікроемульсію, пом’якшують, відновлюють і живлять). У випадках нечітких шкірних змін необхідна консультація дерматолога. У важких генералізованих випадках може виникнути необхідність у призначенні короткого курсу системних кортикостероїдів (преднізон, 40-60 мг/день, зі зниженням дози), що дає ефект.
Внутрішньопечінковий холестаз вагітних (Intrahepatic cholestasis of pregnancy)
Синоніми (попередні назви): акушерський холестаз (obstetric cholestasis), холестаз вагітних (cholestasis of pregnancy), жовтяниця вагітних (ідіоматична) (jaundice of pregnancy), свербіж/пруріго вагітних (pruritus/prurigo gravidarum).
На відміну від інших станів розпочинається зі свербежу, а зміни на шкірі є вторинними. Він включений до класифікації дерматозів вагітних, оскільки рання діагностика важлива для мінімалізації потенційних несприятливих наслідків для плоду. Пов’язаний з порушенням печінкового току жовчі в період вагітності. Частота демонструє чіткі географічні варіації: в середній Європі – 0,2-2,4%, вища в Скандинавії, в Північній Америці становить 0,5-1%, вища в Південній Америці з найвищим рівнем в Чилі – 15-28%. Може накопичуватися в певних сім’ях і повторюватись при наступних вагітностях (45-70%).
Патофізіологія.
Причина мультифакторіальна, із залученням генетичних, гормональних, екзогенних механізмів. Ендемічне поширення та сімейне накопичення вказують на генетичний фон. Нещодавно виявлено мутації певних генів, які кодують транспорт білків, необхідних для екскреції жовчі (наприклад, ген ABCB4 [MDR 3]) у деяких пацієнток з внутрішньо печінковим холестазом вагітних. При нормальному рівні гормонів такий дефект клінічно не проявляється, а тільки на пізніх термінах вагітності та/або на фоні гормональної контрацепції. Більше того, метаболіти естрогену та прогестерону самі по собі мають холестатичну дію. Деякі автори вказують на додаткові фактори навколишнього середовища та харчові, які впливають на маніфестацію внутрішньопечінкового холестазу, такі як зниження рівня селену.
Проявляється на пізніх термінах вагітності у жінок зі спадковою схильністю, які мають дефект (зміни) у виведенні жовчних кислот, що призводить до підвищення їхнього рівня в сироватці. Це і викликає важкий свербіж у матері, а оскільки токсичні жовчні кислоти можуть проникати до циркуляції плода, це може шкідливо впливати на нього внаслідок гострої аноксії плаценти та серцевої депресії. При сімейному анамнезі перебігає важче.
Клінічні прояви.
Внутрішньопечінковий холестаз вагітних проявляється в ІІ та ІІІ триместрах раптовим початком важкого шкірного свербежу, який починається на долонях та підошвах і швидко поширюється. Свербіж триває протягом вагітності і погіршується вночі. Вторинне ураження включає лінійні та розідрані папули, що розвиваються внаслідок розчісування найчастіше на розгинальних поверхнях кінцівок, але можуть залучатися і інші ділянки (сідниці, живіт). Жовтяниця виникає в приблизно 10% пацієнток внаслідок внутрішньопечінкового холестазу, частіше через 2-4 тижні. Ці жінки мають ризик розвитку стеатореї з мальабсорбцією жиророзчинних вітамінів, включно з вітаміном К, що може призводити до кровотеч та холелітіазу.
Діагноз.
Як правило встановлюється на основі характерного симптому – свербежу, який починається з долонь та підошв без висипки. У здорових вагітних загальний рівень жовчних кислот в сироватці в ІІІ триместрі є трошки вищим, ніж поза періодом вагітності і рівень до 11,0 µмол/л вважається нормальним на цьому терміні (норма 0-6 µмол/л). Гіпербілірубінемія відзначається у 10-20%. У жінок з внутрішньопечінковим холестазом вагітних загальний рівень жовчних кислот в сироватці понад 40 µмол/л асоціюється з підвищеним ризиком несприятливих результатів для плода. Також можливе помірне підвищення рівня печінкових трансаміназ включно з аспартатамінотрансферазою та аланінамінотраснферазою. Таке підвищення може виникати тільки через тижні після появи свербежу. Можлива стеаторея з дефіцитом вітаміну К. Може знадобитись моніторинг протромбінового часу. Для виключення холелітіазу та вірусного гепатиту є потреба у проведенні ультразвукового дослідження печінки та серологічних тестів.
Гістопатологія не специфічна, пряма та непряма імунофлюоресценція негативні.
Прогноз.
Прогноз для матері в цілому сприятливий. Свербіж спонтанно зникає за кілька днів після пологів, але може повторюватись при наступних вагітностях або при прийомі гормональних контрацептивів. У випадку виникнення жовтяниці та дефіциту вітаміну К підвищується ризик внутріпологових та постпологових кровотеч. Цей стан асоціюється з несприятливими наслідками для плодів, включно з передчасними пологами (19-60%), меконієм в навколоплідних водах, дистресом плода, загибеллю плода (1-2%). Слід зазначити, що деякі автори повідомляють про загибель плода як раптову подію, незважаючи на нормальне серцебиття до цього. Справді, ретельний моніторинг плода у випадку внутрішньопечінкового холестазу не є ефективним у попередженні загибелі. Тому рекомендується індукція пологів в терміні 36-38 тижнів вагітності. Невідкладна діагностика, специфічна терапія та ретельний акушерський моніторинг є важливими. У неоднозначних та важких випадках рекомендована консультація гастроентеролога.
Лікування.
Ціллю лікування є зниження рівня жовчних кислот в сироватці. Препаратом вибору є урсодезоксихолева кислота, яка полегшує свербіж, знижує рівень печінкових трансаміназ та жовчних кислот, таким чином може зменшувати кількість несприятливих для плодів результатів вагітностей, хоча цей останній ефект є дискусійним. Призначають дозу 15 мг/кг або 1 грам в день, незалежно від ваги, до пологів; одноразово або 2-3 рази на день. До запровадження лікування урсодезоксихолевою кислотою використовували холестирамін, однак, він може спричиняти дефіцит вітаміну К, який вже виникає на фоні внутрішньопечінкового холестазу. Симптоми у матерів можуть пом’якшити антигістамінні препарати. Рекомендоване планове родорозрішення на 36-38 тижнях, оскільки є загроза мертвонародження на 37-39 тижнях. Деякі автори пропонують стимуляцію пологів на 37 тижні тільки у випадках вираженого внутрішньопечінкового холестазу вагітних, який визначається показником жовчних кислот понад 40 µмол/л.
Пемфігоїд вагітних (Pemphigoid gestationis)
Пемфігоїд вагітних – рідкісне аутоімунне захворювання, що характеризується утворенням субепідермальних бульбашок в основному на пізніх термінах вагітності та в післяпологовому періоді, рідше в будь-якому терміні вагітності. Частіше виникає після 20 тижня вагітності, а може спостерігатись тільки в післяпологовому періоді. Частота коливається в межах 1:2000 – 1:50000-60000 в залежності від поширеності HLA-гаплотипів DR3 та DR4. Поза періодом вагітності дуже рідко зустрічається в асоціації з трофобластними пухлинами (хоріокарцинома, міхурцевий занесок).
Раніше вважався проявом герпесу вагітних (herpes gestationis), проте цей стан не має нічого спільного з вірусом герпесу.
Клінічні прояви.
Проявляється вираженим свербежем, який може виникати до появи шкірних змін. Характерна висипка починається з уртикарних елементів, еритематозних папул та бляшок навколо пупка та на кінцівках; субепідермальних бульбашок у вигляді крапель сльози. З прогресуванням процесу розвиваються напружені пухирі. Не має елементів на обличчі, долонях та підошвах. В приблизно 20% випадків залучається і слизова оболонка. Зазвичай пемфігоїд вагітних спалахує перед пологами і спонтанно зникає після них. Патофізіологія аналогічна патогенезу бульозного пемфігоіду та залучає імуноглобулін G, спрямований на гемідесмосомний трансмембранний глікопротеїн.
Діагноз.
Необхідна біопсія шкіри. Стандартом діагностики пемфігоїду вагітних є пряма імунофлюоресцентна мікроскопія шкіри, яка демонструє лінійні відкладення (депозити) компоненту комплементу СЗ в зоні базальної мембрани епідермісу в 100% випадків, а в 30% – ще й відкладення IgG. Також при непрямій імунофлюоресценції в 30-100% випадків можна виявити в крові циркулюючі антитіла IgG. Рівень антитіл корелює з активністю захворювання і також може визначатись в динаміці.
Таких змін не виявляють при інших дерматозах вагітних. Диференціальна діагностика проводиться в основному з поліморфним дерматозом вагітних, особливо на ранній стадії до формування напружених пухирів. Тому у незвичних та важких випадках поліморфного дерматозу вагітних, які не відповідають на рутинну терапію показана біопсія шкіри.
Прогноз.
Перебіг характеризується загостреннями та ремісією під час вагітності з частим покращенням на пізніх термінах та спалахом на момент пологів (75%). Шкірні зміни зникають від кількох тижнів до місяців. Рідко відзначають збереження ураження шкіри протягом кількох років. Можливий рецидив при наступних вагітностях (25%) з більш раннім початком та важчим перебігом. Також можливий рецидив при наступних менструаціях та на фоні гормональної контрацепції. Окрім того існує підвищений ризик інших аутоімунних захворювань, особливо хвороби Грейвса (Дифузний токсичний зоб (хвороба Грейвса) – аутоімунне захворювання, при якому аутоантигеном є рецептор до ТТГ (ТТГР або TSHR). Його активація антитілами анти-ТТГР (anti–TSHR) призводить до збільшення секреції гормонів щитоподібної залози і появи симптомів гіпертиреозу, стимулює ріст щитоподібної залози і розвиток її системи кровопостачання).
Вагітні з пемфігоїдом вагітних відносяться до групи ризику через асоціацію з підвищеним рівнем несприятливих результатів для плодів, таких як передчасні пологи та низька вага при народженні. Тільки нещодавно продемонстровано, що такий ризик корелює з важкістю захворювання, яка оцінюється за раннім початком та формуванням пухирів, а не з призначенням терапії кортикостероїдами, як вважали раніше. Внаслідок пасивного трансферу материнських аутоантитіл до плода у 10% новонароджених можуть спостерігатись помірні шкірні зміни, які спонтанно зникають за кілька днів або тижнів.
Лікування.
Ціллю лікування є контроль свербіння та попередження формування пухирів. У випадку помірної пре-пухирцевої стадії призначають місцево кортикостероїди та перорально антигістамінні препарати. Всі інші випадки потребують системної стероїдної терапії, як правило, це преднізон в дозі 20-60 мг/день (починаючи від 0,5-1 мг/кг/день). З покращенням стану дозу знижують, але згодом її слід підвищувати для попередження спалаху проявів, який виникає в пологах. У випадках, не чутливих до терапії кортикостероїдами, може допомогти імуноаферез. При необхідності після пологів можна призначити імуносупресори.
Атопічний дерматит вагітних (Atopic eruption of pregnancy)
Синоніми: пруріго (почесуха) вагітних (prurigo of pregnancy, prurigo gestationis), пруріго вагітних з раннім початком (early-onset prurigo of pregnancy), сверблячий (еозинофільний) фолікуліт вагітних (pruritic folliculitis of pregnancy), екземи вагітних (eczema in pregnancy).
Цей англомовний термін є збірним, нещодавно запропонованим Ambros-Rudolph для визначення пруріго (почесухи) вагітних, сверблячого (еозинофільного) фолікуліту вагітних, екземи вагітних. Хоча в літературі ці стани описуються по-окремо, відсутність клінічної диференціацію спонукала їх об’єднати. Це доброякісні стани зі свербежем, які включають екзематозні або папульозні ураження у пацієнток з історією атопії після виключення інших дерматозів вагітних.
Це найчастіший дерматоз вагітних – 50% жінок. Починається рано, в 75% – до ІІІ триместру і має тенденцію до повторення при наступних вагітностях через атопічне підгрунтя.
Патогенез.
Причиною вважаються специфічні для вагітності імунологічні зміни – зниження клітинного імунітету та продукції Th1-цитокінів (IL-2, інтерферон гамма, IL-12) в порівнянні з домінантним гуморальним імунітетом та підвищенням секреції Th2-цитокінів (IL-4, IL-10).
Таким чином, загострення існуючого атопічного дерматиту, а також перший прояв атопічних змін шкіри можна пояснити домінуючою імунною реакцією Th2, характерною для вагітності.
Клінічні прояви.
У більшості пацієнток (80%) атопічні зміни шкіри виникають вперше або після довгої ремісії (з дитинства). У більшості жінок (2/3) прояви включають широко розповсюджені екзематозні зміни з локалізацією в типових атопічних ділянках, таких як обличчя, шия, зона декольте, згинальна поверхня кінцівок (Е-тип). В третини жінок спостерігали папули, невеликі еритематозні, розсіяні по тулубу та кінцівках та типові для пруріго вузликові елементи, розміщені на гомілках та плечах (Р-тип). Ключовою ознакою часто є виражена сухість шкіри та основні критерії атопії, розроблені у 1980 році Hanifin та Rajka.
Діагноз.
Основою діагнозу є клінічний перебіг та огляд. Гістопатологія не специфічна та варіює при різних клінічних типах і стадіях захворювання. Пряма та непряма флюоресцентна мікроскопія негативна. Лабораторне тестування може виявити підвищений рівень імуноглобуліну Е. Корисним є посів вмісту пустули для виключення бактеріального або грибкового фолікуліту.
Лікування.
Використання місцевих кортикостероїдів покращує стан. У важких випадках є потреба у системному призначенні короткого курсу кортикостероїдів та антигістамінних препаратів.
Прогноз.
Ці стани не асоціюються з несприятливими наслідками для матері та плода.
Загальні положення щодо лікування в період вагітності (Ambros-Rudolph)
Місцеве лікування.
Базисна терапія з використанням емолієнтів (спеціальні засоби для догляду за шкірою, які в присутності води або без неї утворюють на поверхні шкіри мікроемульсію, пом’якшують, відновлюють і живлять), пристосованих до стану шкіри, є важливою і може містити сечовину (3-10%) та протизапальні добавки, такі як ментол та полідоканол, які вважаються безпечними під час вагітності. Також слід уникати додаткового висушення шкіри при митті, прийомі ванни чи душу і використовувати м’які, не лужні синтетичні миючі засоби, здатні заміщати ліпіди, а також масла (олії) для душу та ванни. Під час вагітності можна застосовувати місцеві кортикостероїди легкої (обличчя, шкірні складки) або помірної дії (решта тіла), переважно нові заміщені препарати, включно з метилпреднізолону ацепонатом та мометазону фуроатом. Необхідно уникати потужних кортикостероїдів та безконтрольного тривалого застосування.
Системне лікування.
У випадку необхідності призначення системно кортикостероїдів в період вагітності також слід обирати не галогеновані кортикостероїди. У плаценті кортизол (гідрокортизон), преднізон та преднізолон інактивуються ензимами (співвідношення мати : дитина становить 10:1), але цього не відбувається з бетаметазоном та дексаметазоном. Препаратом (кортикостероїдом) вибору при вагітності є преднізолон. Звичайна початкова доза становить 0,5-2 мг/кг/день в залежності від природи та важкості захворювання. Підтримуюча доза не повинна перевищувати 10-15 мг/день в І триместрі через незначно підвищений ризик розщілини піднебіння. При лікуванні дерматозів вагітних кортикостероїди як правило призначаються короткими курсами (до 4 тижнів), тому не очікується виникнення побічних наслідків. Рідко, при застосуванні високих доз тривало необхідно моніторувати за допомогою ультразвуку ріст/розвиток плода. Якщо таку терапію необхідно продовжувати до пологів, слід врахувати можливу недостатність наднирників у новонародженого і відповідно лікувати.
Якщо є потреба у системному призначенні антигістамінних препаратів, перевагу слід надавати старішим препаратам, досвід застосування яких є більшим, таким як клемастин, фенірамін. Це особливо актуально для І триместру. У випадку потреби призначення антигістамінних препаратів без седативного ефекту, слід зупинитися на лоратадині або цетиризині (в ІІ та ІІІ триместрах).
Діагностичні підходи до свербежу при вагітності
Скорочення: ІФМ-імунофлюоресцентна мікроскопія.
Діаграма адаптована з Ambros-Rudolph CM. Dermatoses of pregnancy – clues to diagnosis, fetal risk and therapy. Ann Dermatol. 2011 Aug;23(3):265-75. doi: 10.5021/ad.2011.23.3.265. Epub 2011 Aug 6. PubMed PMID: 21909194; PubMed Central PMCID: PMC3162253.
Адаптовано за матеріалами:
- Ambros-Rudolph CM. Dermatoses of pregnancy – clues to diagnosis, fetal risk and therapy. Ann Dermatol. 2011 Aug;23(3):265-75. doi: 10.5021/ad.2011.23.3.265. Epub 2011 Aug 6. PubMed PMID: 21909194; PubMed Central PMCID: PMC3162253.
Адаптовано 01.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 11.01.2025 р.
ХОЛЕСТИРАМІН
Група/призначення:
Гіполіпідемічні засоби. Це аніонобмінна смола, яка в кишечнику утворює комплекси з жовчними кислотами, які не всмоктуються, що і призводить до посилення виведення жовчних кислот з організму та зменшення всмоктування холестерину в кишечнику.
Покази: як засіб ад’ювантної терапії (в доповнення до дієти та фізичних вправ) для зниження підвищеного вмісту холестерину в сироватці хворих з первинною гіперхолестеринемією; як засіб для зниження підвищеного вмісту холестерину у хворих з комбінованою гіперхолестеринемією та гіпертригліцеридемією (однак не показаний у випадку, коли гіпертригліцеридемія є домінуючою патологією); для симптоматичного лікування діареї, викликаної жовчними кислотами у хворих із синдромом короткого кишечнику, а також для зняття свербежу при внутрішньопечінковому холестазі (в тому числі у вагітних). Протипоказаний при повній обструкції жовчних шляхів.
Внутрішньопечінковий холестаз вагітних проявляється в ІІ та ІІІ триместрах з раптовим початком важкого шкірного свербежу, який починається на долонях та підошвах і швидко поширюється. Свербіж триває протягом вагітності і погіршується вночі. Вторинне ураження включає лінійні та розідрані папули, що розвиваються внаслідок розчісування. Жовтяниця виникає в приблизно 10% пацієнтів внаслідок внутрішньопечінкового холестазу, часто супроводжується потемнінням сечі і світлим глинистим стільцем. Ці пацієнтки мають ризик розвитку стеатореї з мальабсорбцією жиророзчинних вітамінів, включно з вітаміном К, що може призводити до кровотеч та холелітіазу.
Див. статтю Шкірний свербіж та вагітність.
Альтернативні назви / синоніми: квестран, колестирамін.
Діюча речовина: холестирамін резин.
Рекомендації при вагітності: сумісний.
Рекомендації при лактації:
Відсутні дані про застосування у людини; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Виходячи з даних від експериментальних тварин не очікується підвищення частоти вроджених вад розвитку. Доступна інформація про один випадок дефіциту вітаміну К в матері та в плода на фоні терапії холестираміном. Теоретично це підтверджується тим, що препарат зв’язується та гальмує абсорбцію різних нутрієнтів, включно з жиророзчинними вітамінами.
Слід зазначити, що препаратом вибору для лікування внутрішньопеінкового холестазу вагітних є урсодезоксихолева кислота (урсодіол).
Інформація щодо досліджень на тваринах:
При репродуктивних дослідженнях препарат давали щурам та кролям в дозах до 2 г/кг/день без несприятливих наслідків для плодів та впливу на фертильність. При порівнянні вагітних та невагітних щурів виявлено, що препарат не знижував концентрації холестерину в плазмі та/або не підвищував синтезу жовчних кислот. Лікування не впливало (при порівнянні з контрольними тваринами) на набирання ваги матерями, кількість та вагу плодів.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Холестирамін використовується для лікування внутрішньопечінкового холестазу вагітних. За винятком описаного вище випадку – дефіциту вітаміну К – не спостерігали несприятливих наслідків при такій терапії.
Одне рев’ю пропонує використовувати холестирамін як препарат першої лінії для лікування свербежу, який супроводжує внутрішньопечінковий холестаз (див. статтю Шкірний свербіж та вагітність). Препарат зв’язується з жиророзчинними вітамінами і довготривале лікування може призвести до їхнього дефіциту в матері та/або плода. При одному з досліджень лікування дозою 9 грам/день протягом 12 тижнів не асоціювалось з ускладненнями з боку матері чи плода.
Повідомляється про 31-річну жінку, яку при 3 вагітності лікували холестираміном (8 г/день), починаючи з 19 тижня з приводу внутрішньопечінкового холестазу вагітних. На 22 тижні дозу збільшили до 16 г/день. Через 4 тижні з’явилась жовтяниця і на 29 тижні провели ультразвукове дослідження через скарги на зменшення рухів плода. При цьому виявили обширні двобічні субдуральні гематоми з гідроцефалією, гепатомегалію, двобічні плевральні випоти. Протромбіновий індекс матері був значно підвищеним, але відповів на введення 2 доз вітаміну К внутрішньовенно. Через тиждень після індукції пологів в зв’язку з дистресом плода народилась дитина вагою 1660 грам, яка померла через 15 хвилин. Вважають, що субдуральні гематоми виникли в результаті дефіциту вітаміну К, спричиненого холестираміном, холестазом або обома чинниками.
Повідомлення 1989 року інформує про використання холестираміну та інших препаратів для лікування запальних захворювань кишечника при вагітності. Холестирамін отримувало 7 жінок. Одна з них народила передчасно (до 37 тижня), а один з новонароджених був малим для гестаційного віку (менше 10-го перцентилю). Обидва ці випадки були радше пов’язані із захворюванням матерів, аніж з лікуванням.
В моніторинговому дослідженні Michigan Medicaid Recipients, яке охопило 229101 завершену вагітність в період між 1985 та 1992 роками, виявлено 4 новонароджених, які зазнали впливу холестираміну в І триместрі та 33 – після І триместру. Не зареєстровано жодного випадку вроджених вад розвитку.
Повідомлення 2006 року описало жінку на 28 тижні вагітності з внутрішньопечінковим холестазом. Вона спочатку отримувала холестирамін, який змінили на два окремі курси урсодіолу, що призвело до зменшення рівня трансаміназ та жовчних кислот. Незважаючи на лікування плід вагою 3400 грам загинув на 39 тижні. Аутопсія виявила меконій в бронхіолах та альвеолах, інших аномалій не виявляли. Причину смерті плода не встановлено.
Рев’ю 2013 року щодо використання препаратів для лікування холестазу вагітних порівнювало вплив урсодезоксихолевої кислоти та плацебо і виявило невелике, але істотне зменшення свербіння шкіри. Одне з досліджень не виявило підвищення частоти несприятливих результатів вагітностей у 62 жінок. Окрім того, даних було недостатньо для визначення ефективності інших препаратів у лікуванні холестазу вагітних. Інші препарати були наступними: S-аденозилметіонін (адеметіонін), гуарова камедь, активоване вугілля, дексаметазон, холестирамін, шалфей, відвар Yinchenghao, Danxioling, Yiganling (самостійно або в комбінації).
Відомо про випадки призначення холестираміну жінкам, яких лікували лефлуномідом (імуносупресор), для прискорення елімінації останнього з моменту діагностики вагітності. При цьому не спостерігали несприятливих наслідків.
Застосування препарату під час вигодовування:
Холестирамін є смолою, яка не абсорбується. Відсутня інформація про лікування в період лактації.
Оскільки препарат зв’язує жиророзчинні вітаміни, тривале лікування може призвести до дефіциту цих вітамінів у матері та немовляти на грудному вигодовуванні.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 01.01.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 02.01.2018 р.
УРСОДІОЛ
Група/призначення:
Холелітолітичні засоби. Урсодезоксихолева кислота (УДХК) є епімером хенодезоксихолевої кислоти, гідрофільною жовчною кислотою без цитотоксичних властивостей. Це найменш агресивна жовчна кислота – природний компонент жовчі людини, становить 1-5 % від загальної кількості жовчних кислот в організмі людини.
Покази: внутрішньопечінковий холестаз, холестаз вагітних.
Внутрішньопечінковий холестаз вагітних проявляється в ІІ та ІІІ триместрах з раптовим початком важкого шкірного свербежу, який починається на долонях та підошвах і швидко поширюється. Свербіж триває протягом вагітності і погіршується вночі. Вторинне ураження включає лінійні та розідрані папули, що розвиваються внаслідок розчісування. Жовтяниця виникає в приблизно 10% пацієнтів внаслідок внутрішньопечінкового холестазу, часто супроводжується потемнінням сечі і світлим глинистим стільцем. Ці пацієнтки мають ризик розвитку стеатореї з мальабсорбцією жиророзчинних вітамінів, включно з вітаміном К, що може призводити до кровотеч та холелітіазу.
Див. статтю Шкірний свербіж та вагітність.
Альтернативні назви / синоніми:
Урсодезоксихолева кислота, урсохол, урсодекс, урсофальк, урсосан, урдокса.
Діюча речовина: урсодезоксихолева кислота.
Рекомендації при вагітності: сумісний.
Рекомендації при лактації:
Відсутні дані про застосування у людини; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Урсодіол ефективний для лікування холестазу при вагітності і ризик для плода здається низьким. Дослідження продемонстрували істотне зниження материнської захворюваності та смертності плодів. Не має пояснення випадку мертвонародження, але такі ускладнення відомі при нелікованому холестазі.
Інформація щодо досліджень на тваринах:
При введенні з харчування вагітним щурам в дозі до 200 мг/кг/день не спостерігали несприятливих наслідків. При іншому дослідженні у щурів відзначали ембріотоксичність, але меншу, ніж при використанні близької жовчної кислоти хенодіолу та не виявляли гепатотоксичності. Репродуктивні дослідження у щурів з дозами, які у 22 рази перевищували максимальні рекомендовані для людини, виходячи з площі поверхні тіла, та кролів, з 7-кратними дозами, не виявили ознак порушення фертильності та шкоди для плодів.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Урсодіол всмоктується у тонкому кишечнику та екскретується і зв’язується в печінці. Хоча 30-50% дози може проникнути до системного кровотоку, постійне поглинання печінкою утримує низький рівень урсодіолу в крові, а іншими органами препарат не захоплюється. Цей факт в поєднанні зі щільним зв’язуванням з альбуміном може припускати відсутність плацентарного трансферу.
Випадкове лікування 4 жінок терапевтичними дозами в І триместрі вагітності не вплинуло на плодів/новонароджених.
Кілька повідомлень, згаданих вище, описали відносну безпечність урсодіолу на пізніх термінах вагітності з приводу лікування внутрішньопечінкового холестазу.
Коротке повідомлення 1991 року описало використання урсодіолу в лікуванні внутрішньопечінкового холестазу з пізнім початком в період вагітності. 30-річна першовагітна отримувала 600 мг/день урсодіолу двома дозами протягом 20 днів, починаючи з 37 тижня вагітності. Народилась здорова дівчинка вагою 2670 грам, оцінкою за шкалою Апгар 9 та 10 балів на 1-й та 5-й хвилинах, відповідно.
Інше повідомлення 1992 року коротко інформувало про успішний результат вагітності 8 жінок з внутрішньопечінковим холестазом, які отримували урсодіол в дозі 1 г/день протягом 3 тижнів. Лікування почалось після 25 тижнів у 8 випадках, з них 5 жінок приймали 1 г/день роздільними дозами двома курсами по 20 днів, а інші 3 отримували аналогічну дозу двома 20-денними курсами, розділеними інтервалом у 14 днів. Середня доза становила 14 мг/кг/день (12-17 мг/кг/день). У всіх новонароджених оцінка за шкалою Апгар становила понад 7 балів на 1-й та 5-й хвилинах, всі діти нормально розвивались при спостереженні до віку 5 місяців.
У 1994 році повідомили про використання урсодіолу в дозі 450 мг/день при 3 вагітностях (одноплідна, двоплідна, чотириплідна) для лікування внутрішньопечінкового холестазу. Лікування розпочали через безуспішну спробу контролю захворювання холестираміном або адеметіоніном. Одноплідну вагітність лікували з 29 тижня до пологів на 37 тижні, двоплідну – з 27 до 33 тижнів, четвероплідну – з 21 тижня до пологів на 30 тижні. Не спостерігали несприятливих наслідків у 8 новонароджених.
Істотне зниження перинатальної смертності та захворюваності, асоційованої з холестазом при вагітності, при використанні урсодіолу повідомило дослідження 1995 року. 8 жінок з 13 вагітностями в анамнезі та внутрішньопечінковим холестазом звернулись до медичної установи перед заплідненням. Супровід застосували при 12 з 13 вагітностях з 11 несприятливими наслідками: 8 мертвонароджень, 2 передчасні пологи, 1 загибель в перинатальному періоді, 1 ургентний кесаревий розтин через дистрес плода. В наступному 3 жінки знову завагітніли і в кожної з них повторився холестаз. Лікування урсодіолом розпочали на 31, 33 та 37 тижнях дозами 750 мг/день (дві жінки) та 1000 мг/день (одна жінка), відповідно. Першу пацієнтку попередньо лікували адеметіоніном з 16 до 31 тижнів, це була невдала спроба попередити холестаз. Кожна з 3 жінок продемонструвала швидке клінічне покращення, повернення до норми печінкових проб після початку терапії урсодіолом. Здорові діти народились на 35 (двоє) та 38 тижнях, відповідно.
Подвійне сліпе плацебо-контрольоване дослідження в групі жінок з внутрішньопечінковим холестазом при вагітності порівнювало лікування урсодіолом (N=8) з плацебо (N=8). В групі урсодіолу зазначили істотне зниження свербежу та рівня всіх печінкових показників, а в контрольній групі – покращення тільки рівня свербежу та аланін амінотрансферази. Більше того гестаційний вік на момент пологів становив 38 тижнів в основній групі проти 34 тижнів в контрольній (р<0,01), що призвело до більшої середньої ваги новонароджених – 2935 проти 2025 грам. Дистрес плода відзначали в 4 випадках контрольної групи і в жодному в основній, ці діти народились шляхом кесаревого розтину. В основній групі 6 з 8 дітей народились у вагінальних пологах. Спостереження до віку 5 місяців не виявило відхилень. Ряд інших досліджень виявили безпечність та ефективність урсодіолу для лікування холестазу при вагітності.
Повідомлення 2006 року описало жінку на 28 тижні вагітності з внутрішньопечінковим холестазом. Вона спочатку отримувала холестирамін, який змінили на два окремі курси урсодіолу, що призвело до зменшення рівня трансаміназ та жовчних кислот. Не дивлячись на лікування плід вагою 3400 грам загинув на 39 тижні. Аутопсія виявила меконій в бронхіолах та альвеолах, інших аномалій не виявляли. Причину смерті плоду не встановлено.
Рев’ю 2013 року щодо використання препаратів для лікування холестазу вагітних порівнювало вплив урсодезоксихолевої кислоти та плацебо і виявило невелике, але істотне зменшення свербіння шкіри. Одне з досліджень не виявило підвищення частоти несприятливих результатів вагітностей у 62 жінок. Крім того даних було недостатньо для визначення ефективності інших препаратів у лікуванні холестазу вагітних. Інші препарати були наступними: S-аденозилметіонін (адеметіонін), гуарова камедь, активоване вугілля, дексаметазон, холестирамін, шалфей, відвар Yinchenghao, Danxioling, Yiganling (самостійно або в комбінації).
Подвійне сліпе плацебо-контрольоване дослідження в групі 20 жінок з внутрішньопечінковим холестазом вагітних виявило, що лікування урсодезоксихолевою кислотою протягом 14 днів в ІІІ триместрі не чинило несприятливого впливу на матерів, плодів чи новонароджених.
Клінічне дослідження 2014 року порівнювало рівень жовчних кислот в сироватці матерів та плодів при 46 вагітностях на фоні лікування урсодезоксихолевою кислотою та 15 нелікованих вагітностях. Таке лікування зменшувало концентрацію жовчних кислот як в материнському, так і в плодовому відділах. Також препарат не викликав клінічно значимого зростання концентрації літохолевої кислоти у плодів.
Застосування препарату під час вигодовування:
Оскільки тільки невелика кількість урсодіолу потрапляє до системної циркуляції і він щільно зв’язується з альбуміном, то до грудного молока проникає невелика кількість препарату.
Повідомляється про жінку, яка приймала 750 мг/день протягом вагітності та в післяпологовому періоді. В грудному молоці препарат не визначався (рівень нижчий за межу визначення). Концентрація цього препарату в грудному молоці 7 жінок була нижчою за показник у жінок з нелікованим первинним біліарним цирозом печінки.
У 2010 році повідомили про нормальний розвиток немовляти на грудному вигодовуванні, мама якого з приводу біліарного цирозу почала приймати урсодезоксихолеву кислоту в дозі 500 мг/день з 5 тижня лактації, а з 11 тижня – 1500 мг/день. Концентрація в грудному молоці була нижчою за 0,5 мкМ протягом періоду лактації.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.