Editor
ЛЕВАЛБУТЕРОЛ
Група/призначення:
Бета-адреноміметики (син. бета-адреностимулятори, бета-агоністи, β-адреностимулятори) для лікування бронхіальної астми. Це R-енантіомер* (право-обертаючий енантіомер) сальбутамолу (албутеролу).
|
*Енантіомери — це стереоізомери, які є неідентичними повними дзеркальними відображеннями один одного (як права і ліва рука). |
Альтернативні назви / синоніми: ксопенекс, левосальбутамол.
Діюча речовина: левалбутамол.
Рекомендації при вагітності:
Відсутні дані про застосування у людини; ймовірно сумісний.
Рекомендації при лактації:
Відсутні дані про застосування у людини; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Відсутній досвід застосування у людини при вагітності. Оскільки сальбутамол (албутерол) вважається сумісним з вагітністю, немає підстав не вважати левалбутерол також сумісним.
Інформація щодо досліджень на тваринах:
Репродуктивні дослідження проводились у кролів з дозами, які у 110 разів перевищували добову інгаляційну для людини. Ці дози не були тератогенними. Однак, сальбутамол (албутерол) виявився тератогенним для мишей та кролів.
Інформація щодо впливу на плід:
Відсутній досвід застосування у людини.
Невідомо, чи левалбутерол проникає до плаценти, але його молекулярна вага це припускає. Однак, концентрація в плазмі після інгаляційного застосування є низькою.
Застосування препарату під час вигодовування:
Відсутній досвід застосування у людини. Молекулярна вага левалбутеролу припускає проникнення до грудного молока. Однак, концентрація в плазмі після інгаляційного застосування є низькою. Вплив на плід невідомий, але препарат, ймовірно, є сумісним з грудним вигодовуванням.
Вплив на фертильність (чоловіків та жінок): відсутність інформації.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 30.03.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 26.04.2016 р.
ЦУКРОВИЙ ДІАБЕТ ТА ВАГІТНІСТЬ
Цукровий діабет (ЦД) – це порушення обміну речовин, при якому не відбувається нормального засвоєння клітинами організму цукру (глюкози) з крові. Абсолютна відсутність інсуліну буває при І типі ЦД. При ІІ типі ЦД інсулін є, його може бути більше, ніж потрібно, але він не працює.
Цукровий діабет під час вагітності (короткий висновок):
Дослідження продемонстрували, що жінки з добре контрольованим діабетом перед вагітністю та низьким рівнем глюкози під час вагітності не мають підвищеного ризику народження дитини з вродженими дефектами.
Високі рівні глюкози під час вагітності збільшують ймовірність народження дитини з вродженими вадами, особливо якщо такий вплив відбувається на плід на ранніх стадіях вагітності, можливо, навіть, поки жінка ще не знає про вагітність.
За деякими оцінками діти матерів з цукровим діабетом в 2-10 разів частіше мають вроджені вади розвитку, найчастіші з яких залучають скелетну, кардіоваскулярну та центральну нервову системи, а рідше сечостатеву та шлунково-кишкову системи.
При плануванні вагітності слід підібрати лікування для утримання рівня глюкози в нормальних межах.
Згідно рекомендації британської національної служби охорони здоров’я (NHS) жінкам з цукровим діабетом, І або ІІ типів, діагностованим до вагітності, в період планування вагітності рекомендована вища за звичайну доза фолієвої кислоти – 5 мг щоденно.
Інформація щодо впливу на плід:
При погано контрольованому діабеті ризик народження дитини з вродженими вадами становить 6-10%, якщо діабет не контролюється в І триместрі, то ризик може підвищуватися до 20%.
Вроджені вади розвитку, характерні для дітей матерів з цукровим діабетом:
- Синдром каудальної регресії (відсутність крижової кістки; відсутність поперекових хребців на різних рівнях; поєднані аномалії інших органів та систем – кінцівок, шлунково-кишкового тракту та сечостатевої системи)
- Гіпоплазія стегна та незвичайного обличчя синдром
- Розщілина хребта (спинномозкова кила; spina bifida) з гідроцефалією та інші вади ЦНС
- Аненцефалія
- Кардіоваскулярні вади: транспозиція магістральних судин, дефекти міжшлункової та міжпередсердної перетинок
- Атрезія анусу та прямої кишки
- Вади нирок: агенезія, мультикистоз, подвоєння сечоводу
- Вади шлунково-кишкового тракту: зворотнє розміщення, трахеостравохідна нориця, атрезія кишечника
При погано контрольованому діабеті також зростає ризик самовільного переривання вагітності, мертвонароджень, прееклампсії, багатовіддя, передчасних пологів. Новонароджені мають підвищений ризик дихальних розладів, гіпоглікемії та жовтяниці.
За деякими даними, навіть, якщо при вагітності діабет ретельно контролюється, у 65% дітей таких матерів виникають наступні ускладнення: гіпоглікемія, гіпербілірубінемія, гіпокальціемія, поліцитемія.
У матерів з діабетом більша ймовірність народження дитини з великою вагою (понад 4 кг). В таких випадках рекомендується кесаревий розтин.
Результати одного з клінічних досліджень свідчать, що частота вроджених вад у дітей матерів з діабетом не цілком залежить від контролю глікемії в період органогенезу. Незважаючи на такі висновки, існує загальноприйнята згода, що правильний метаболічний контроль діабету до моменту зачаття та протягом вагітності є найкращим шляхом для отримання сприятливих результатів вагітностей серед жінок з цим захворюванням.
Ускладнення вагітності частіше зустрічаються та є більш загрозливими, якщо у жінки крім діабету присутні гіпертензія та ожиріння.
Вплив лікування на плід.
Для лікування діабету застосовується інсулін тваринний, людський або синтетичний. Дослідження продемонстрували, що лікування інсуліном при вагітності не асоціювалось із зростанням частоти вроджених вад розвитку. Більш того, інсулін є препаратом вибору при вагітності.
Оральні протидіабетичні препарати також не асоціюються з підвищенням частоти вроджених вад розвитку.
Гестаційний діабет.
Це діабет, який діагностується при вагітності, як правило у терміні 24-28 тижнів. Більшість жінок з гестаційним діабетом не мають симптомів, він виявляється при обов’язковому тестуванні вагітних, але деякі вагітні скаржаться на спрагу, часте сечовипускання, втому.
Більшість жінок з гестаційним діабетом можуть контролювати рівень глюкози за допомогою дієти та фізичних вправ, а частина потребує пероральних препаратів чи ін’єкцій інсуліну. В деяких жінок після пологів рівень глюкози в крові повертається до норми, але близько 50% жінок будуть страждати діабетом в майбутньому.
Оскільки гестаційний діабет виникає, як правило, в ІІ триместрі, він не призводить до зростання частоти вроджених вад розвитку. Однак, цей стан пов’язують з народженням дітей з великою вагою. При поганому контролі гестаційного діабету існує підвищена ймовірність гіпоглікемії та дихальних розладів у новонародженого.
Рідше гестаційний діабет виникає в І триместрі і тоді може підвищуватися ризик вроджених вад розвитку у плода, як і при діабеті в цілому.
Цукровий діабет під час вигодовування:
Жінки з цукровим діабетом можуть вигодовувати немовлят, але діабет повинен добре контролюватися. При деяких дослідженнях виявлено, що надмірний рівень глюкози у матері проникає до грудного молока у вигляді цукру і призводить до гіпоглкемії та підвищення апетиту новонароджених.
Діабет може пригнічувати продукцію грудного молока. Інсулін необхідний для виробітку грудного молока, тому цим пояснюється пригнічення продукції молока при цьому захворюванні.
Деякі дослідники припускають, що грудне вигодовування може знижувати ймовірність розвитку діабету та ожиріння в дитини в майбутньому.
При лікуванні діабету в період вигодовування інсулін не проникає до грудного молока у великих кількостях. Він є сумісним з грудним вигодовуванням.
При прийомі жінкою пероральних протидіабетичних препаратів в період лактації слід контролювати немовлят на наявність ознак гіпоглікемії.
У деяких матерів при грудному вигодовуванні знижується потреба в інсуліні. Матері з діабетом І типу часто відчувають зниження рівня цукру після годування дитини.
Вплив на фертильність (чоловіків та жінок):
Однією з найчастіших причин неплідності у жінок вважаються синдром полікистозних яєчників (Polycystic Ovarian Syndrome (PCOS) та дисметаболічний синдром Х (Dysmetabolic Syndrome X), які асоціюються з ожирінням та діабетом.
У чоловіків ураження нервів при діабеті може призводити до ретроградної еякуляції. Іншим ускладненням діабету є еректильна дисфункція.
У 2007 році наведено попередні дані про можливе пошкодження ДНК сперматозоїдів при цукровому діабеті І типу, що, ймовірно, порушує фертильність.
Адаптовано за матеріалами:
- Сайт “MotherToBaby a service of the Organization of Teratology Information Specialists (OTIS)” (http://www.mothertobaby.org/).
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
- Diabetic care services and pharmacy (US MED site). Available at: http://www.diabeticcareservices.com/diabetes-education/diabetes-and-infertility [Accessed 21 Mar 2016].
- Diabetes and pregnancy. National Health Service of UK (NHS) website [Accessed 24 Mar 2021].
Адаптовано 21.03.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 26.04.2016 р.
ХВОРОБА, ЯКУ СПРИЧИНЮЄ ВІРУС ЗІКА ТА ВАГІТНІСТЬ
Назва англійською мовою: Zika virus, Zika virus infection, Zika virus and pregnancy.
Синоніми:
Вірус Зіка та вагітність; гарячка Зіка та вагітність, Zika вірус.
| ВІРУС ZIKA Є ВИЗНАНИМ ТЕРАТОГЕНОМ ДЛЯ ЛЮДИНИ |
Хвороба, яку спричинює вірус Зіка під час вагітності (короткий висновок):
Вірус Зіка, зазвичай, викликає грипоподібне захворювання з м’яким перебігом, що може включати в себе лихоманку, головний біль, біль в суглобах і/або біль в м’язах, кон’юнктивіт, іноді висипку на тілі. Симптоми починаються через 3-7 днів після укусу зараженого комара і можуть тривати від кількох днів до тижня. Не кожна інфікована вірусом особа матиме симптоми, а тільки 1 з 5. Жінки можуть передавати вірус своїй дитині під час вагітності. Восени 2015 року повідомили про зростання частоти новонароджених з мікроцефалією та іншими аномаліями головного мозку в Бразилії. Матері цих дітей повідомили, що при вагітності перенесли грипоподібне захворювання, а в деяких з них була висипка. В окремих жінок був позитивний результат на наявність вірусу Зіка. Мікроцефалія – це, зазвичай, рідкісна хвороба. У США, як правило, реєструється від 2 до 12 випадків на 10 тисяч новонароджених. Мікроцефалія є досить поширеною в певних районах Бразилії, де її частота становить 1% від всіх народжень. Міністерство охорони здоров’я Бразилії повідомляє про 5909 випадків мікроцефалії або інших вад нервової системи у новонароджених за період від 22 жовтня 2015 року до 27 лютого 2016 року. Також повідомляється про асоціацію між вірусною інфекцією та водянкою плода і внутріутробною загибеллю плода.
Чому потенційний зв’язок між вірусом Зіка і вродженими дефектами не досліджували раніше?
У районах центральної Африки та Азії, де вірус Зіка був поширеним протягом десятиліть, більшість людей заражається в ранньому віці, тому ризик виникнення первинної інфекції під час вагітності є досить незначним. Дотепер населення Америки не мало контакту з вірусом. Це означає, що більшість жінок під час вагітності вперше стали інфіковані. А це, в свою чергу, підвищує ризик народження дітей з вадами.
Інформація щодо впливу на плід:
Поки невідомо, на якому терміні вагітності інфекція, викликана вірусом Зіка може нанести найбільшої шкоди плоду. Зараження на ранніх термінах вагітності, очевидно, буде більш шкідливим, ніж на більш пізніх. Уже відомо, що деякі типи вірусу можуть бути шкідливими для плода як в І, так і в ІІ триместрах.
Вірус Зіка під час вигодовування:
Поки що немає повідомлень про передачу вірусу Зіка через грудне молоко.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Додаткова інформація:
У жовтні 2013 – квітні 2014 років у Французькій Полінезії зареєстрована найбільша епідемія вірусної інфекції, викликаної вірусом Зіка. В цей же період відзначили зростання частоти синдрому Гієна-Барре, що припускає можливу асоціацію між цими двома подіями. Так, 41% пацієнтів з синдромом Гієна-Барре мали IgM або IgG до вірусу Зіка і всі 100% мали нейтралізуючі антитіла проти вірусу Зіка при порівнянні з 56% в контрольній групі. 93% пацієнтів з синдромом Гієна-Барре мали IgM до вірусу Зіка, а 88% перенесли вірусне захворювання в середньому за 6 днів до появи неврологічних симптомів, припускаючи інфекцію, викликану вірусом Зіка.
Стани, асоційовані з інфікуванням вірусом Зіка:
ВРОДЖЕНИЙ СИНДРОМ – ZIKA-ВІРУС СИНДРОМ:
|
| Синдром Гієна-Барре (Guillain-Barré syndrome) – це гостра аутоімунна запальна полірадикулонейропатія, яка проявляється млявими парезами і паралічами, порушеннями чутливості, вегетативними розладами. Так як на сьогодні поліомієліт є майже усуненим у більшості країн світу, то синдром Гієна-Барре залишається на даний час найбільш частою причиною гострого млявого паралічу і являє собою одну з серйозних надзвичайних ситуацій в неврології. Також синдром Гієна-Барре може бути описаний як сукупність клінічних синдромів, що включають гостру запальну полірадикулонейропатію з наявністю слабкості та уповільнення рефлексів. |
Повідомляється про випадки передачі вірусу статевим шляхом.
Кращою формою профілактики є захист від укусів комарів. Вакцини для профілактики або лікування вірусу не існує.
Британська біотехнологічна компанія Oxitec створила генетично модифікованих комарів виду Aedes Aegypti шляхом введення двох генів в їхнє ДНК. Завдяки одному з них, личинки комарів світяться під ультрафіолетовим світлом. За словами науковців, це допоможе ідентифікувати комах, що переносять інфекцію. Інший ген спричиняє смерть всього потомства комара. В Oxitec говорять, що заселення генетично модифікованими комарами заражених територій допоможе зменшити передачу вірусу Зіка більш, ніж на 80%.
Адаптовано за матеріалами:
- Сайт “MotherToBaby a service of the Organization of Teratology Information Specialists (OTIS)” (http://www.mothertobaby.org/).
- Інформація Центрів по контролю і запобіганню захворювань (Centers for Disease Control and Prevention(CDC)): http://www.cdc.gov/media/dpk/2016/dpk-zika-virus.html.
- Інформація Всесвітньої організації здоров’я (World Health Organization (WHO)): http://www.who.int/mediacentre/factsheets/zika/en/.
- Інформація Пан-Американської організації охорони здоров’я (Pan American Health Organization. (PAHO)): http://www.paho.org/hq/index.php?option=com_content&view=article&id=11585&Itemid=41688&lang=en.
- Bazley T. Zika virus facts you need to know. Available at http://www.aljazeera.com/news/2016/01/threat-zika-qa-160131093108840.html [Accessed 3 Feb 2016].
- Cao-Lormeau VM, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, Dub T, Baudouin L, Teissier A, Larre P, Vial AL, Decam C, Choumet V, Halstead SK, Willison HJ, Musset L, Manuguerra JC, Despres P, Fournier E, Mallet HP, Musso D, Fontanet A, Neil J, Ghawché F. Guillain-Barré Syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study. Lancet. 2016 Feb 29. pii: S0140-6736(16)00562-6. doi: 10.1016/S0140-6736(16)00562-6. [Epub ahead of print].
Адаптовано 21.03.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 26.04.2016 р.
ДЕПРЕСІЯ ТА ВАГІТНІСТЬ
Депресія – серйозний психологічний розлад, від якого нерідко страждає не тільки сам хворий, але і його родина. Депресивні розлади можуть виникнути в будь-якому віці, в будь-якій соціальній групі.
Депресія під час вагітності (короткий висновок):
Ймовірність розвитку депресії для жінок протягом життя становить 10-25%. Найвищий ризик існує в репродуктивному віці. У деяких жінок пусковим механізмом розвитку депресії є вагітність, що пов’язують зі зміною гормонального статусу та стресом.
| Два дослідження повідомляють про частоту депресії при вагітності на рівні 7-13% |
Інформація щодо впливу на плід:
Деякі дослідження повідомляють про підвищення частоти самовільного переривання вагітності, передчасних пологів, малої ваги при народженні, народження малих для гестаційного віку дітей у випадку нелікованої при вагітності депресії. Одне дослідження повідомляє про підвищену частоту розвитку прееклампсії у жінок з депресією.
Нелікована депресія може також негативно вплинути на подальший розвиток та поведінку дитини.
Окрім того, припинення лікування депресії загрожує рецидивом. Так, вважається, що ризик рецидиву при вагітності в 5 разів вищий, якщо жінка припинила прийом препаратів для лікування депресії при порівнянні з вагітними, які продовжують лікування. Проте ризик рецидиву залишається в будь-якому випадку.
Депресія при вагітності асоціюється зі зловживанням легальними та нелегальними препаратами. Деякі жінки намагаються таким чином лікувати депресію. Однак, зловживання алкоголем та іншими речовинами і препаратами є більш шкідливим, ніж належне лікування депресії. Вживання алкоголю, навіть в невеликій кількості, та паління, а також прийом наркотиків при вагітності пов’язують з негативними наслідками для вагітної та немовляти. Тому депресію слід лікувати призначеними лікарем медичними препаратами.
Більшість антидепресантів не асоціюється з підвищеним ризиком вроджених вад розвитку. При прийомі антидепресантів в ІІІ триместрі у новонароджених можливі дратівливість, порушення сну, порушення частоти дихання та серцебиття. В більшості випадків ці симптоми спостерігаються протягом кількох днів.
Пренатальний нагляд.
Дослідження продемонстрували, що жінки, які страждають психічними захворюваннями, включаючи депресію, нехтують медичним наглядом при вагітності. В цій групі жінок виявлено вищі показники передчасних пологів і смертності немовлят та породілль.
Післяпологова депресія.
Найсерйознішим наслідком нелікованої депресії при вагітності є ризик виникнення післяпологової депресії. Частота післяпологової депресії в загальній популяції становить 5-15% і є вищою у жінок з депресією при вагітності. Припускається, що післяпологова депресія впливає на здатність доглядати дитину та порушує з’язок матері з дитиною, що може мати негативний вплив на розвиток та поведінку дитини.
Депресія під час вигодовування:
Грудне вигодовування покращує здоров’я як матері, так і дитини. Жінки з депресією протягом вагітності можуть вигодовувати немовлят коротший період часу. Таке раннє припинення грудного вигодовування може призвести до повернення симптомів депресії. Якщо жінка здатна продовжувати грудне вигодовування, то прояви захворювання зменшуються і це може навіть попередити післяпологову депресію. Підтримка жінки на ранніх стадіях грудного вигодовування дозволяє їй годувати дитину довший час і є найкращим вибором як для жінки, так і для дитини.
Вплив на фертильність (чоловіків та жінок):
Можливе виникнення депресії на фоні неможливості завагітніти. У всіх пацієнтів з неплідністю є певні симптоми депресії.
Адаптовано за матеріалами:
- Сайт “MotherToBaby a service of the Organization of Teratology Information Specialists (OTIS)” (http://www.mothertobaby.org/).
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 21.03.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 26.04.2016 р.
ВАКЦИНА ПРОТИ ХОЛЕРИ
Група/призначення:
Вакцина. Покази: профілактика холери.
Альтернативні назви / синоніми: немає.
Діюча речовина: інактивовані бактерії.
Рекомендації при вагітності: сумісна.
Рекомендації при лактації: сумісна.
Прийом під час вагітності (короткий висновок):
Холера при вагітності значно підвищує смертність та захворюваність матері та плода, особливо в ІІІ триместрі. Ризик для плода у випадку вакцинації при вагітності невідомий.
Американська колегія акушерів та гінекологів вважає, що покази до введення вакцини не змінюються з вагітністю.
Інформація щодо досліджень на тваринах: відсутні.
Інформація щодо впливу на плід:
Відсутній досвід застосування.
Застосування препарату під час вигодовування:
Вакцинація при лактації призводить до зростання титру антитіл IgA в грудному молоці, хоча попередні дослідження припускають, що рівень антитіл, індукованих вакцинацією, занадто низький для забезпечення імунітету для немовляти. Повідомляється про вакцинацію 6 жінок в період лактації і значного підвищення у 5 з них титру IgA.
Незважаючи на це, вакцинація матері може захистити немовля від клінічно важкої холери шляхом попередження прямого інфікування дитини від матері.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 04.04.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 26.04.2016 р.
ВАКЦИНА ПРОТИ МЕНІНГОКОКОВОЇ ІНФЕКЦІЇ
Група/призначення:
Вакцина. Покази: профілактика менінгококової інфекції.
Альтернативні назви / синоніми:
Полісахаридна менінгококова вакцина А, С, Y; меномун, менактра.
Доступні наступні формули: 1) полісахаридна менінгококова вакцина групи А, С, Y; 2) комбінована W-135 (меномун A/C/Y/W-135); менактра – штами Neisseria meningitidis серогруп А, С, Y та W-135, білок-носій дифтерійний анатоксин.
Діюча речовина:
Препарат являє собою ліофілізовану суху речовину.
Рекомендації при вагітності: сумісна.
Рекомендації при лактації:
Відсутня інформація про використання у людини; ймовірно сумісна.
Прийом під час вагітності (короткий висновок):
Ризик від вакцинації при вагітності невідомий. При одному дослідженні при вакцинації зареєстрували трансфер до плода материнських антитіл, але він був нерегулярним і не залежав від титру антитіл в матері та терміну вагітності при проведенні вакцинації.
Інформація щодо досліджень на тваринах:
Не проводились з меномуном. У мишей проводились тератологічні дослідження з менактрою. Доза, яка у 900 разів перевищувала рекомендовану для людини, виходячи з площі поверхні тіла, не впливала на фертильність, показники материнської смертності, виживання плодів, постнатальний розвиток. Один з 234 плодів мав розщілину піднебіння і жодний- в контрольній групі. Це була єдина виявлена аномалія, яка, як вважається, не пов’язана з вакциною.
Інформація щодо впливу на плід:
Дослідження 1998 року аналізувала результати вагітностей 34 жінок, які були вакциновані при вагітності, з них 4 (11,8%) в І триместрі, 17 (50%) в ІІ триместрі, 13 (38,2%) в ІІІ триместрі. Результати вагітностей: 34 одноплідні пологи, середній термін нагляду за дітьми 13,2 місяці (1-24 місяці), 1 випадок вродженої вади розвитку. Вроджена вада діагностована у дитини, мама якої отримала вакцину у терміні 33 тижнів. Це був синдром Чарлі М*, який зустрічається з частотою <0,00002%. Такий симптомокомплекс мав би формуватися на ранніх термінах вагітності, генетична природа його не доведена, як і зв’язок з тератогенезом.
|
*Charlie M syndrome) – рідкісне порушення розвитку, що належить до групи синдромів оромандибулярного гіногенезу кінцівок і включає гіпоглоссію, гіподактилію, глосо-піднебінний анкілоз. Основні аномалії: гіпоплазія нижньої щелепи, синдактилія, ектродактилія, малий рот, розщілина піднебіння, гіподонтія, парез обличчя, також гіпертелоризм. |
Рев’ю 1994 стверджує, що вакцина протипоказана при вагітності. Однак, у 1996 році при дослідженні в групі 75 жінок, які вакциновані в ІІІ триместрі, не виявлено несприятливих наслідків у новонароджених.
Застосування препарату під час вигодовування: відсутня інформація.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
- Сайт “MotherToBaby a service of the Organization of Teratology Information Specialists (OTIS)” (http://www.mothertobaby.org/).
Адаптовано 10.04.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 25.04.2016 р.
КРИТИЧНІ ПЕРІОДИ РОЗВИТКУ ПЛОДУ ТА ЧУТЛИВІСТЬ ДО РІЗНИХ ФАКТОРІВ
Альтернативні назви:
Вплив різних факторів в критичні періоди розвитку плоду. Вплив медикаментів в критичні періоди розвитку плоду. Чутливі періоди розвитку плоду та вплив різних факторів.
Виділяють певні періоди при вагітності (критичні), коли формування органів і систем плоду відбувається особливо інтенсивно і він особливо чутливий до дії зовнішніх чинників, таких як хімічні агенти, в тому числі лікарські препарати, радіація, тощо.
Розрізняють наступні періоди:
Перший критичний період – це перші три місяці вагітності, тобто час, коли відбувається закладання і формування тканин і органів плода. Особливо вразливим зародок є на 5-6-й день після зачаття, коли відбувається прикріплення заплідненого яйця в порожнині матки. У цей період розвитку зародок або переносить вплив шкідливих факторів без негативних наслідків, або гине (закон «все або нічого»). На 3-8 тижнях вагітності відбувається процес формування плаценти, який збігається з етапом поділу клітин майбутніх органів і систем плода (органогенез). Ураження зародка саме в цей період веде до виникнення вроджених вад розвитку. При цьому анатомічні порушення виникають в тих органах, які в момент дії шкідливих факторів активно розвивалися.
Другий критичний період: 15-20-й тиждень вагітності. У цей період відбувається посилений ріст головного мозку. На 20-24 тижнях поряд із подальшим зростанням органів плода відбувається становлення і розвиток найважливіших функціональних систем організму (кровообігу, згортання крові, центральної нервової системи та інших). Пошкодження плода в цей час не призводить до формування вади розвитку, але може зумовити виникнення внутрішньоутробного захворювання.
Третій критичний період: 28-34 тижні вагітності. Шкідливі впливи, зокрема, гострі інфекційні захворювання матері, в цей період можуть призвести до передчасних пологів, народження дітей з малою вагою, слабких і навіть до мертвонародження.
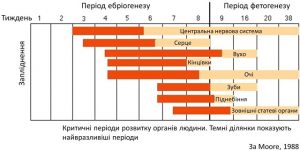
Відомі критичні періоди для кожного органу і системи, що демонструє класична діаграма, створена Moore. Темні смуги на діаграмі демонструють період найбільшої чутливості певного органу до дії шкідливих факторів та ризику основних вроджених вад. Мова йде про великі вроджені вади розвитку. Так, для центральної нервової системи критичним (чутливим) періодом розвитку вроджених вад є 3-5 тижнів, серця – 3,5-6 тижнів, вуха – 4,5-9,5 тижнів, кінцівок – 4,5-7 тижнів, ока – 4,5-8,5 тижнів, зубів – 6-8 тижнів, піднебіння – 6-8 тижнів, зовнішніх геніталій – 7,5-10 тижнів – як видно з діаграми. В основному вади формуються у терміні 3-12 тижнів вагітності. Невеликі і функціональні дефекти нервової системи формуються і на пізніших термінах вагітності.
Питання, які часто можуть виникати при вагітності:
Чи змінюється ризик виникнення певних вроджених вад під час вагітності ?
Так, ризик залежить від того, який орган чи система дитини розвивались в момент впливу медикаменту чи іншого фактору. Якщо орган на цей час вже був сформований, то вада розвитку вже не може виникнути, але можливий вплив на ріст та функцію певного органу.
Який найбільший ризик при впливі чинників на дуже ранніх термінах вагітності?
При впливі на дуже ранньому терміні вагітності існує найвищий ризик самовільного переривання вагітності. Можливий викидень навіть до того, як жінка розуміє, що вона вагітна. На цій ранній стадії клітини ембріону мають велику здатність до відновлення. Якщо викидень не відбувся, то вважається, що формування вроджених вад є малоймовірним.
Перші 4 тижні вагітності називають «все або нічого». «Все» – це важке пошкодження, що призводить до викидня. «Нічого» – вплив, який не дає наслідків.
Який найвищий ризик при впливі протягом І триместру вагітності?
При впливі в І триместрі є високий ризик вроджених вад розвитку.
Який найвищий ризик при впливі у ІІ та ІІІ триместрах?
При впливі в ІІ та ІІІ триместрах виникають проблеми росту і можуть формуватися незначні вроджені вади. При цьому також виникають функціональні порушення в майбутньому, такі як проблеми з навчанням. І, нарешті, застосування певних медичних препаратів в кінці вагітності може призвести до синдрому відміни в деяких новонароджених.
Чи означає це, що вплив може бути шкідливим в певний час під час вагітності, але не в інший час?
Так. Наприклад, якщо жінці призначено препарати, які підвищують ймовірність вад серця, то при прийомі в ІІІ триместрі вади не виникатимуть. Відомо, що критичним періодом формування вад серця є 3 – 6 тижні вагітності. Тому призначення в цей період і може призвести до вроджених вад серця у плода.
Адаптовано за матеріалами:
- Сайт “MotherToBaby a service of the Organization of Teratology Information Specialists (OTIS)” (http://www.mothertobaby.org/).
Адаптовано 21.03.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 21.04.2016 р.
АСТЕМІЗОЛ
Група/призначення:
Антигістамінний препарат, Н1-блокатор.
Альтернативні назви / синоніми: гісманал.
Діюча речовина: астемізол.
Рекомендації при вагітності:
Обмежені дані про використання у людини; дані від експериментальних тварин припускають низький ризик.
Рекомендації при лактації:
Відсутні дані про застосування у людини; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Хоча антигістамінні препарати в цілому вважаються безпечними при вагітності, досвід застосування астемізолу при вагітності занадто обмежений, щоб виключити ризик для плода. Доки не буде отримано більше інформації, найбезпечнішою рекомендацією є уникнення призначення астемізолу в період органогенезу. Астемізол вилучений з фармацевтичного ринку США та Європи через рідкі, але іноді фатальні побічні ефекти з боку серцево-судинної системи.
Інформація щодо досліджень на тваринах:
Згідно з інструкцією до препарату астемізол не підвищує частоти вроджених вад при введенні вагітним щурам та кролям дози, яка у 200 разів перевищувала рекомендовану для людини. Ембріолетальність спостерігали при токсичних для матерів дозах. При введенні вагітним щурам дози, яка у 50 разів перевищувала рекомендовану для людини, спостерігали затримку росту плодів та порушення спарювання у самців. Відмічали ламкість скелету у потомства щурів, лікованих дозами в 150-350 разів вищих від рекомендованої для людини. Повідомлення 2010 року виявило, що одноразова доза астемізолу (80 мг/кг), введена щурам на 13 день гестації призводила до дефектів пальців. Автори припустили, що астемізол може порушити функцію серця і викликати тератогенні ефекти, залежні від гіпоксії.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Невідомо, чи астемізол проникає до плаценти, але його молекулярна вага це припускає.
Проспективне дослідження двох тератологічних інформаційних служб порівнювало результати 114 вагітностей з впливом астемізолу в І триместрі з 114 вагітними контрольної групи, які звернулись в одну тератологічну службу з приводу прийому нетератогенних препаратів. 76 жінок приймали астемізолу 10 мг/день до 16 тижня вагітності, а 38 жінок – триваліший період. Кінцеве інтерв’ю проводилось через 6 місяців після пологів. Не виявлено значимої різниці між групами щодо ваги новонароджених, набирання ваги при вагітності, гестаційного віку, спонтанних та медичних абортів, мертвонароджень. По 2 вроджені вади зареєстровані в 2 групах – по 1,9%. В групі астемізолу: гіпоспадія та закрита розщілина хребта (spina bifida occulta); в обох випадках вплив у І триместрі. В контрольній групі зареєстровані дефект міжшлуночкової перетинки та окулярна форма міопатії. Автори дійшли висновку, що астемізол є безпечним при вагітності.
Однак, автори листа 1998 року заперечили вищенаведені результати, підрахувавши відносний ризик вроджених вад при вживанні астемізолу на рівні 7,5, але визнали, що їхня вибірка була замалою для визначення ризику.
Коротке рев’ю 1997 року щодо Н1-блокаторів І та ІІ покоління дійшло висновку, що при вагітності перевагу слід надавати препаратам І покоління. Так, автори рекомендують хлорфенірамін для перорального введення та дифенгідрамін при потребі парентерального лікування. Вони також вважають, що при потребі призначення препаратів ІІ покоління, наприклад, астемізолу, слід уникати цього в період органогенезу.
Інше дослідження спостерігало за 81 вагітністю з впливом астемізолу і виявило 4 вроджені вади: вроджений вивих стегна, дуплікацію збірних трубочок нирки, дефекти міжпередсердної та міжшлуночкової перетинок.
Застосування препарату під час вигодовування:
Відсутня інформація. Невідомо, чи астемізол проникає в грудне молоко, але його молекулярна вага це припускає.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 22.02.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 02.03.2016 р.
ВІЛ-ІНФЕКЦІЯ ТА ВАГІТНІСТЬ
ВІЛ-інфекція – це соціально небезпечне інфекційне захворювання, що розвивається внаслідок інфікування вірусом імунодефіциту людини (ВІЛ), довготривалого переживання (персистенції) ВІЛ в лімфоцитах, макрофагах та клітинах нервової тканини. Хвороба характеризується прогресуючою дисфункцією імунної, нервової, лімфатичної та інших систем організму. Відповідно до сучасних уявлень ВІЛ-інфекція відноситься до невиліковних хвороб, має тривалий хронічний перебіг і, в разі відсутності ефективної терапії, закінчується смертю хворого.
Віруси імунодефіциту людини (ВІЛ-1, ВІЛ-2) є ретровірусами, які викликають синдром набутого імунодефіциту (СНІД) у людей. Активна передача ВІЛ-2 від матері до дитини і від партнера до партнера виявляється нижчою, ніж ВІЛ-1.
ВІЛ-інфекція під час вагітності (короткий висновок):
Синдром вродженої ВІЛ-інфекції не був підтверджений. ВІЛ-інфіковані жінки можуть передавати вірус до плода/дитини протягом вагітності, пологів, лактації. Стратегія зниження трансмісії включає призначення противірусної терапії та вибіркове застосування кесаревого розтину. Історично склалось так, що грудне вигодовування не рекомендоване, якщо доступним є безпечне альтернативне харчування, але деякі антивірусні препарати зменшують трансмісію інфекції до грудного молока, рекомендації щодо грудного вигодовування можуть змінюватися.
Інформація щодо впливу на плід:
Вертикальна трансмісія ВІЛ-інфекції
Передача інфекції від матері до дитини є важливим шляхом інфікування. Трансмісія вірусу до плода виникає при трансплацентарному трансфері при вагітності та через родові шляхи в пологах. Також підвищений ризик трансмісії асоціюється з процедурою накладання електродів на шкіру в ділянці черепа для визначення серцебиття (fetal scalp electrode) та забором крові плода з судин шкіри черепа. При процедурі амніоцентезу у 166 випадках не спостерігали значного зростання частоти трансмісії.
У дітей нелікованих інфікованих матерів частота інфікування становила 15-40%.
Мультицентрове європейське дослідження 1980 років з охопленням 721 дитини, народженої 701 жінкою встановило рівень вертикальної трансмісії – 14,4% у 18 місяців та пізніше після пологів.
При попередніх дослідженнях високий ризик трансмісії асоціювався з материнською р24-антигенемією (альтернативний прогностичний маркер при ВІЛ-інфекції) та кількістю СD41, меншою за 700 /мкл.
|
1Кількість CD4 показує наскільки сильно ВІЛ вразив імунну систему, яка глибина інфекційного процесу, який ризик інших інфекцій, коли необхідно починати лікування. Середня кількість CD4 клітин для ВІЛ-негативної людини коливається від 600 до 1900 кл. /мл крові. |
Дослідження 1989 року, проведене в Заїрі з охопленням 324-х ВІЛ-1 інфікованих жінок встановило, що кількість CD82 лімфоцитів (в середньому 1800/мкл) при наявності материнської р24-антигенемії асоціювалась з найвищим ризиком трансмісії.Інше дослідження виявило, що біля 1/3 дітей, народжених ВІЛ-позитивними жінками мають ознаки ВІЛ-інфекції до віку 18 місяців життя.
|
2Кількість CD4- і CD8-позитивних клітин – маркери прогресування ВІЛ-інфекціі в імунокомпроментованих ВІЛ-інфікованих пацієнтів. |
Антитіла до вірусу (серопозитивність) передаються через плаценту і повільно виводяться з організму немовляти за кілька місяців. Виведення материнських антитіл не корелює з ризиком розвитку захворювання у дитини. У невеликого відсотка ВІЛ-позитивних немовлят вірус може повністю вивестися з організму і в них не розвинеться хронічна інфекція. Згідно з повідомленням 2014 року раннє лікування ВІЛ-інфекції для повного вилікування після перинатальної трансмісії не було успішним.
У 1994 році продемонстровано, що призначення матері зидовудину (нуклеозидний інгібітор зворотної транскриптази) при вагітності та в пологах з подальшим лікуванням новонародженого протягом 6 тижнів зменшує вертикальну трансмісію ВІЛ-1 приблизно на 2/3.
Починаючи з 1996 року дослідження з використанням комбінації 3 препаратів – невірапіну, ламівудину, ставудину (всі нуклеозидні інгібітори зворотної транскриптази) – підтвердило ефективність істотного зниження перинатальної трансмісії ВІЛ-1. Ймовірним механізмом такого ефекту є зниження материнського вірусного навантаження (кількість віруса в крові інфікованого).
Американська колегія акушерів та гінекологів представила у 2000 році і підтвердила у 2008 керівництво щодо проведення кесаревого розтину ВІЛ-інфікованим жінкам. Важливим в цих рекомендаціях є факт відсутності користі від такого родорозрішення у жінок з вірусним навантаженням менше 1000 копій /мл або вже після початку пологів чи розриву оболонок. Деякі дані припускають, що ризик захворюваності після кесаревого розтину у жінок з ВІЛ-1 інфекцією може бути підвищеним.
Призначення антиретровірусних препаратів зросло з періоду ранніх 1990 років і було висловлено занепокоєння через те, що надмірне використання зидовудину може призвести до поширення резистентних штамів. Призначення невіпраміну в пологах також може збільшувати частоту резистентності до препаратів. З 2006 року рекомендується проводити тест на резистентність перед початком лікування раніше нелікованих вагітних жінок.
Докладні рекомендації щодо застосування зидовудину для зниження перинатальної передачі ВІЛ-інфекції розроблені американською суспільною службою охорони здоров’я (US Public Health Service) та британською ВІЛ-асоціацією (British HIV Association). Оновлені рекомендації щодо лікування доступні на наступному сайті: http://www.aidsinfo.nih.gov. Створено реєстр вагітностей з вживанням антиретровірусних препаратів (Antiretroviral Pregnancy Registry) для моніторингу вагітностей: http://www.apregistry.com.
Недоношеність.
Деякі дослідники описують недоношеність при вагітностях, ускладнених материнською ВІЛ-інфекцією, хоча адекватних контрольованих досліджень не проводилось. При одному дослідженні щодо з’ясування результатів вагітностей ВІЛ-інфікованих жінок не виявлено різниці частоти недоношеності, порушень функції плаценти, ускладнень інфікування, крім інфекцій, що передаються статевим шляхом, інших ускладнень у немовлят при порівнянні з групою неінфікованих жінок.
Хоча рідко, але все ж таки повідомляється про зростання частоти тромботичної тромбоцитопенічної пурпури при вагітності у ВІЛ-інфікованих пацієнток. Група лікарів попереджає, що при такому стані може бути помилково діагностована прееклампсія.
Вроджені вади розвитку.
На додаток до ризику вродженої інфекції з’явились повідомлення про асоційований з ВІЛ-інфекцією синдром вроджених вад. Ознаки включали відставання розвитку, аномалії середньої частини обличчя, мікроцефалію, що відповідає критеріям ВІЛ. Матері цих дітей, з великою ймовірністю, зловживали іншими препаратами при вагітності. Хоча автори одного з таких досліджень вважають, що мальформації у дітей виникли від впливу препаратів, а не від ВІЛ-інфекції, причина дизморфій не була встановлена. Ні лицеві дизморфії, ні інші вроджені вади не асоціювалися з материнською ВІЛ-інфекцією при дослідженні 308 немовлят з групи ризику.
Ряд досліджень також аналізували можливі побічні наслідки антиретровірусної терапії у ВІЛ-позитивних жінок. Хоча досвід застосування найновіших препаратів був обмеженим, давніше використовувані медикаменти вважалися безпечними.
Аналіз народжень 2009 року у великій французькій когорті продемонстрував, що високоактивна антиретровірусна терапія3 не підвищує частоти народження малих для гестаційного віку дітей.
|
3Високоактивна антиретровірусна терапія ВААРТ (HAART) – комбінація 3 і більше різних препаратів (два нуклеозидні інгібітори зворотної транскриптази4 та інгібітори протеази5, два нуклеозидні інгібітори зворотної транскриптази та ненуклеозидні інгібітори зворотної транскриптази6, або інші комбінації). 4Нуклеозидні інгібітори зворотної транскриптази — це група антиретровірусних препаратів, які мають структурну подібність з нуклеотидними основами, що входять до складу ДНК або РНК, що забезпечує властивість препаратів групи конкурентно блокувати фермент вірусу ВІЛ або вірусу гепатиту B, зворотну транскриптазу та вибірково інгібувати реплікацію вірусної ДНК. До цієї групи належить перший препарат, що був затверджений для лікування СНІДу — зидовудин, зареєстрований у 1987 році. Більшість препаратів групи активні до вірусу ВІЛ-1 та ВІЛ-2, частина препаратів групи активна до вірусу гепатиту B. 5Інгібітори протеази — це група антиретровірусних препаратів, механізм дії яких полягає у блокуванні ферменту вірусу ВІЛ — протеази, який необхідний для розщеплення поліпротеїнових попередників вірусу на окремі білки, що входять у склад вірусу, та порушують утворення білків вірусного капсиду. Препарати групи активні проти вірусу ВІЛ-1 та ВІЛ-2. 6Ненуклеозидні інгібітори зворотньої транскриптази — це група антиретровірусних препаратів, що не мають структурної подібності із нуклеотидними основами, які входять у склад ДНК або РНК, та блокують активний центр ферменту вірусу ВІЛ-1 зворотню транскриптазу неконкурентним шляхом, блокують активність ДНК- та РНК-залежних полімераз вірусу ВІЛ-1, не інгібують α-, β- та γ-ДНК-полімерази організму людини. Ненуклеозидні інгібітори зворотньої транскриптази діють на ранніх стадіях розвитку ВІЛ-інфекції, тому ефективно діють у клітинах, що були інфіковані недавно. Препарати групи активні виключно до ВІЛ-1. До ненуклеозидних інгібіторів зворотної транскриптази відносяться невірапін, ефавіренз, делавірдин, етравірин. |
Дослідження з охопленням немовлят, народжених від ВІЛ-інфікованих жінок в Румунії повідомляє про вроджені вади на рівні 39% (96/244 випадків). Частота ВІЛ-інфекції серед немовлят становила 16%. Найчастішими аномаліями були вроджені вади серця (47/96), вади кістково-м‘язової системи (24/96), дефекти нервової системи (20/96), урогенітальні вади (13/96). Ризик вроджених вад не асоціювався з ВІЛ-трансмісією або прийомом антиретровірусних препаратів до та під час І триместру. У 9 випадках діагностовані важкі вроджені вади, включаючи комбіновану ваду серця, агангліоз кишечника (хвороба Гіршпрунга), атрезію ануса, синдром Денді-Уокера, гангліозидоз, хворобу Німана-Піка, синдром Дауна, істинний гермафродитизм, розщілину піднебіння.
Проспективне дослідження групи ВІЛ-інфікованих матерів та їхніх немовлят в Іспанії продемонструвало частоту вроджених вад на рівні 6,9% (95% ДІ 5,4-9,1). В 19 випадках (31%) виявлено вади статевої та сечової систем, в 17 (27%) – кардіоваскулярної системи. Не виявлено зростання частоти вроджених вад при порівнянні немовлят, які зазнали впливу антиретроврусних препаратів в І триместрі з дітьми, матері яких не отримували лікування. Не виявлено асоціації між впливом окремих антиретровірусних препаратів та вродженими вадами.
Неврологічний розвиток.
Рання нелікована ВІЛ-інфекція може порушувати неврологічний розвиток. ВІЛ-негативні діти віком 5-13 років, які пренатально та постнатально отримували противірусні препарати, не продемонстрували порушень когнітивного та навчального розвитку. У підлітків, які були перинатально інфіковані ВІЛ і зазнали впливу противірусних препаратів, можливе зростання частоти кардіоваскулярних захворювань.
ВІЛ-інфекція під час вигодовування:
ВІЛ був знайдений в грудному молоці інфікованих жінок, тому вважається, що грудне вигодовування може викликати деякі випадки педіатричної інфекції. ВООЗ рекомендує жінкам з ВІЛ-інфекцією відмовитись від грудного вигодовування, якщо існує безпечне альтернативне харчування для немовляти.
Виходячи з невеликої когорти жінок в Австралії та Руанді визначили трансмісію, асоційовану з грудним вигодовуванням на рівні 27-40%. Дослідження 1993 року виявило, що комбінація ВІЛ-інфікованих клітин в молоці з порушенням IgM відповіді була найважливішим предиктором інфікування.
Деякі дослідники вважають, що компоненти грудного молока можуть відігравати захисну роль у зменшенні прогресування ВІЛ-інфекції у дітей, які отримали вірус пренатально.
У квітні 2007 року дослідження в Південній Африці порівнювало ризик трансмісії ВІЛ-1 та рівень виживання немовлят в асоціації з виключно грудним вигодовуванням та при використанні інших видів вигодовування. Серед 1286 немовлят в цьому дослідженні 14,1% (95% ДІ 12,0-16,4%) на виключно грудному вигодовуванні були інфіковані ВІЛ-1 у віці 6-тижнів і 19,5% – після 6 місяців. Однак, немовлята на грудному вигодовуванні, які також отримували тверду їжу, мали більшу ймовірність отримати інфекцію, ніж ті немовляти, які отримували виключно грудне молоко, так само як і діти, які до 12 місяців отримували як грудне молоко, так і суміші (змішане вигодовування). Сукупна смертність у віці 3 місяців в групі виключно грудного вигодовування становила 6,1% (95 ДІ 4,74-7,92) проти 15,1% (95% ДІ 7,63-28,73) у немовлят, які отримували не молочні суміші.
Рекомендації щодо грудного вигодовування у ВІЛ-позитивних жінок продовжують змінюватися та вдосконалюватися. Застосування антиретровірусних препаратів при вагітності та лактації значно знижує ризик постнатальної трансмісії при грудному вигодовуванні.
На сьогодні американська академія педіатрії та центри з контролю та профілактики захворювань (CDC) радять матерям в США, інфікованим ВІЛ не годувати дітей грудним молоком, оскільки існують безпечні альтернативні суміші для немовлят. ВООЗ інформує, що в країнах, де національні органи охорони здоров’я заохочують грудне вигодовування та використання антиретровірусних препаратів, ВІЛ-інфікованим матерям радять вигодовувати немовлят, принаймні, до віку 12 місяців. Не рекомендується штучне вигодовування, якщо невідома його якість та безпечність в країнах, з обмеженим використанням антиретровірусної терапії. При неможливості забезпечення виключно грудного вигодовування альтернативами є штучні суміші та обробка молока (пастеризація).
Вплив на фертильність (чоловіків та жінок):
У чоловіків.
При аутопсії яєчок чоловіків, хворих на СНІД, виявлено зниження сперматогенезу. Цілком можливо, що за такі наслідки можуть бути відповідальними супутні інфекції або /та ослаблення організму в цих чоловіків. Поширення ВІЛ-інфекції у чоловіків асоціювалось зі зниженням концентрації сперматозоїдів та зростанням числа морфологічно аномальних сперматозоїдів, але такі наслідки зменшувались при лікуванні зидовудином. Це припускає токсичність вірусу для тканини яєчок. Одне дослідження повідомляє про зростання частоти порушення рухливості сперматозоїдів в невеликій групі ВІЛ-позитивних чоловіків, яким розпочато лікування різними комбінаціями антиретроврусних препаратів.
Повідомляється про кілька випадків трансмісії ВІЛ при штучному заплідненні (інсемінації), але обгрунтованість одного випадку сумнівна. Тим не менше, CDC рекомендує тестувати донорів сперми в момент її отримання, надалі сперму заморожувати і утримувати мінімум 6 місяців, проводити ре-тестування донорів перед застосуванням сперми для запліднення. Деякі клініцисти повідомляють про низьку частоту трансмісії вірусу від чоловіка до жінки при природньому зачатті. Відмивання сперми не продемонструвало ефективності в обмеженні трансмісії ВІЛ при штучному заплідненні.
У жінок.
ВІЛ-інфіковані жінки на фоні антиретровірусної терапії перед штучним заплідненням демонструють нижчий рівень фертильності в порівнянні з неінфікованими жінками. Такий ефект радше виникає від мітохондріальної токсичності деяких антиретровірусних препаратів, ніж від самої ВІЛ-інфекції.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org)
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0
Адаптовано 21.03.2016 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету
Переглянуто редакційною колегією 20.04.2016 р.
ЦИТОМЕГАЛОВІРУСНА ІНФЕКЦІЯ ТА ВАГІТНІСТЬ
Цитомегаловірусна інфекція — інфекційна хвороба з групи герпевірусних інфекцій, яку спричинює цитомегаловірус (ЦМВ). Ця інфекція характеризується різноманітними проявами — від безсимптомного перебігу до важких генералізованих форм з пошкодженням внутрішніх органів і центральної нервової системи, особливо за наявності імунодефіциту.
Цитомегаловірусна інфекція під час вагітності (короткий висновок):
Цитомегаловірусна інфекція при вагітності може призвести до інфікування плода з ураженням нервової системи та очей. Питома вага плодів із серйозними наслідками є низькою.
Інформація щодо впливу на плід:
У великої кількості вагітних жінок наявні серологічні ознаки перенесеної інфекції, а в деяких можлива реактивація вірусу при вагітності. Жінки, які мають антитіла до одного штаму ЦМВ? можуть інфікуватися іншим штамом з можливістю виникнення вродженої інфекції у плода. Жінки з імунітетом до ЦМВ (серологічно підтвердженим) можуть мати ризик народження дитини з вродженою інфекцією при наступних вагітностях.
Вроджена ЦМВ-інфекція виникає в 1% новонароджених, але важке інфікування – з частотою 1-5 випадків на 20000 народжень. Вищу частоту захворюваності спостерігали при дослідженні у дітей з дуже малою вагою при народженні та у матерів з імунодефіцитом, обумовленим ВІЛ-інфекцією.
Якщо інфікування жінки вперше відбулося при вагітності, то ризик трансмісії вірусу до плодf становить 30-50%, а ризик вродженої ЦМВ-інфекції – 5-15%.
Внутрішньоутробне інфікування ЦМВ може асоціюватися з мікроцефалією та іншими аномаліями головного мозку. Однак, більшість новонароджених, які виділяють з сечею цитомегаловірус, не мають мікроцефалії і інфекція у них, як правило, протікає безсимптомно.
Вроджена ЦМВ-інфекція також може асоціюватися із судомами, хоріоретинитом, сліпотою, та/або глухотою. Також повідомляється про передчасні пологи, внутрішньоутробну загибель та затримку розвитку плода.
Повідомляється про випадок народження трійні, де 1 дитина не була уражена, 1 – ЦМВ-позитивна, але без симптомів, 1 – з симптомами ЦМВ-інфекції.
Окремі повідомлення та нерандомізовані дослідження припускають, що введення цитомегаловірусного імуноглобуліну може зменшити симптоми та частоту ЦМВ-інфекції у дітей вагітних жінок з первинним інфікуванням. Рандомізоване плацебо-контрольоване дослідження не змогло підтвердити користь від такого лікування.
Виходячи з результатів тільки невеликої кількості народжень, несприятливі наслідки у новонароджених були більш ймовірними при наявності в період вагітності у матері симптомів ЦМВ-інфекції в порівнянні з безсимптомним перебігом. При деяких дослідженнях не виявили зв’язку між тим, в якому триместрі виникла інфекція та ступенем ураження немовляти, але інші коментатори вважають ризик перебігу інфекції з видимими симптомами (на відміну від асимптоматичного перебігу) вищим, якщо первинне інфікування відбулося в перші 6 місяців вагітності.
Повідомляється про дослідження з проведенням серій ультразвукових обстежень, яке виявило значно вищий ризик аномалій плода у випадку, коли материнська ЦМВ-інфекція виникала від періоду преконцепції і протягом І триместру.
Дослідження випадок-контроль щодо раку яєчок у хлопчиків продемонструвало очевидний захисний ефект материнських імуноглобулінів G (IgG) в консервованій сироватці. Автори припустили, що постнатальна ЦМВ-інфекція може бути пов’язана з розвитком раку яєчок, а материнські антитіла можуть відігравати захисну роль.
У 18 дітей з дуже низькою вагою при народженні та вродженою ЦМВ-інфекцією (Алабама) виявили вищу частоту наступних аномалій при порівнянні з контрольною групою: втрату слуху (67% проти 9%), порушення нейровізуалізації (72% проти 25%), порушення розвитку рухових функцій (43% проти 9%). Контрольну групу склали 4583 немовлята з дуже низькою вагою при народженні. В цьому дослідженні вроджена ЦМВ-інфекція не асоціювалась із загибеллю немовлят.
Вертикальну трансмісію цитомегаловірусу від матері до плода можна встановити з 90% вірогідністю, використовуючи методи виділення вірусу чи полімеразну ланцюгову реакцію на зразках амніотичної рідини. Ультразвукове дослідження може ідентифікувати вроджені вади розвитку, однак, в інфікованих немовлят в 20% випадків можуть виникати неврологічні порушення навіть при відсутності ультразвукової візуалізації дефектів. Ризик інфікування збільшується, якщо матері або немовляті проводять переливання крові, без доведеної серонегативності до ЦМВ (лейкоцити є носіями ЦМВ-вірусу).
Цитомегаловірусна інфекція під час вигодовування:
У доношених дітей ризик інфікування ЦМВ залежить від тривалості грудного вигодовування. Недоношені діти більш схильні до інфікування та прояву симптомів ЦМВ-інфекції в порівнянні з доношеними немовлятами. Занепокоєння щодо наявності проникнення цитомегаловірусу до грудного молока призвело до дослідження сироваткових та клітинних фракцій грудного молока, для визначення, яка з них відіграє основну роль в передачі. Вірус частіше виділяли із зразків сироватки, ніж з клітинної фракції. Хоча повідомлення 1980 років інформують, що заморожування і подальше розморожування грудного молока інактивує цитомегаловірус, клінічні та експериментальні дані ставлять під сумнів адекватність такого методу попередження передачі вірусу. Альтернативним методом може бути пастеризація грудного молока – нагрівання до 72°С.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Сайт “MotherToBaby a service of the Organization of Teratology Information Specialists (OTIS)” (http://www.mothertobaby.org/).