Editor
РТУТЬ
Група/призначення:
Хімічний елемент. Ртуть – це важкий, срібно-білий металічний елемент, який стає рідким (плаваючим) при кімнатній температурі. Ртутні солі та складні ефіри є більш токсичними, ніж сама елементарна ртуть. Ртуть у вигляді металу є ліпофільною, ртутні пари набагато швидше розповсюджуюся в тканинах мозку, аніж ртутні солі. Ртуть у вигляді металу не проникає швидко через плаценту, але метилртуть проникає до плаценти людини. Нейротоксичний ризик органічної ртуті, включаючи метилртуть, може не стосуватися ртуті як металу чи ртутних солей. Швидкість транспортування метлртуті до мозку перевищує цей показник для парів ртуті в 10 разів.
Тімеросал (консервант, антисептик, що використовується при виробництві вакцин в багатодозових флаконах) містить 49,6% ртуті і метаболізується до етилртуті та тіосаліцилату. Припускається, що етилртуть є менш токсичною, ніж метилртуть, вплив якої вважається стандартом при дослідженнях.
Місцевий вплив неорганічних ртутних мазей, таких як червоний та жовтий ртутні оксиди може бути пов’язаним з поглинанням ртуті. Додатковим джерелом неорганічної ртуті є кіновар (циніум, цинобра), природній ртутний сульфат, який застосовується в китайській медицині. Вміст ртуті в кремах для освітлення шкіри може бути джерелом впливу на вагітних жінок.
Концентрація ртуті в пуповинній крові та меконії може бути індикатором впливу на плід ртуті протягом вагітності. В одному дослідженні вміст ртуті в пуповинній крові був вищим за вміст ртуті в материнській крові на момент пологів.
Концентрація ртуті у волоссі може відображати довготривалий вплив, тому що волосся відростає приблизно на 1 см за місяць, а концентрація в нігтях через повільний ріст може відображати вплив протягом попереднього року. Концентрація ртуті в нігтях може демонструвати ртутне навантаження організму в попередні 5 місяців. Клінічний випадок описує спостереження за зниженням рівня ртуті у жінки, яка планувала вагітність.
Альтернативні назви / синоніми:
Метилртуть, сульфід ртуті, кіновар, бромід ртуті, хлорид ртуті, оксид ртуті.
Діюча речовина: ртуть.
Рекомендації при вагітності:
Надмірний вплив асоціюється зі специфічними неврологічними розладами.
Рекомендації при лактації:
Переваги грудного вигодовування вищі від потенційного ризику; при підозрі на високий рівень у матері потрібен моніторинг, особливо в певних популяціях з високим рівнем споживання риби та морепродуктів.
Прийом під час вагітності (короткий висновок):
Надмірний вплив метилртуті протягом вагітності асоціювався з неврологічними розладами у дітей. Неорганічна ртуть, яка міститься в амальгамі*, не впливає несприятливо при вагітності за умови правильного використання.
Оскільки риба може бути забруднена метилртуттю, слід дотримуватись рекомендацій FDA щодо умов та режиму споживання, див. «рибну діаграму» -Fish Chart.
|
*Амальгама – це сплав ртуті з іншим металом; більшість металів, крім заліза та платини, можуть бути частиною амальгами. Застосовують в стоматології для пломбування зубів; стоматологічна амальгама складається з міді, срібла і цинку, вона залишається м’якою протягом деякого часу після змішування, потім твердіє. |
Інформація щодо досліджень на тваринах:
Внутрішньовенне введення хлориду ртуті перед пологами щурам призвело до присутності ртуті в плаценті та в тканині плода, найбільший вміст ртуті був в нирках плоду, печінці та головному мозку. Давніші дослідження повідомляють про наступі результати: у хом’яків внутрішньоутробний вплив хлориду ртуті або феніл ртуті ацетату асоціювався з вродженими вадами розвитку, включаючи розщілину губи та піднебіння, синдактилію, екзенцефалію та клишоногість після інтраперитонеального застосування у матерів на 8 день вагітності або 5, 8 чи 9 дні вагітності. Такий шлях введення не є показовим для людини.
Вплив ацетату феніл ртуті на вагітних мишей при дозі 38 мг/кг на 7 день вагітності став причиною загибелі ембріонів, порушення розвитку плодів, аномалій хвоста. Пероральне лікування вагітних мишей на 6-17 дні вагітності затримувало диференціацію мозочку при дозі 1 мг/кг/день, але не мало такого ефекту при дозі 0,1 мг/кг/день. Смерть плодів та новонароджених наступала після призначення матерям дози 5 мг/кг/день. Інтраперитонеальне застосування вагітним мишам в дозах 2, 4 або 8 мг/кг метилртуті дициандіаміду одноразово в період розвитку ембріону спричинило порушення росту, затримку розвитку, розщілину губи та піднебіння, смерть. «Незначні поведінкові зміни», не класифіковані іншим чином, були помічені після інтраперитонеального введення цієї сполуки на 7 або 9 дні вагітності, резорбція плодів виникала після введення 4 мг/кг на 10 день вагітності.
Пероральне введення вагітним щурам хлориду метилртуті в дозі 2,5 мг/кг/в день на 6-15 дні вагітності спричинило затримку розвитку плода, введення щурам 5 або 10 мг/кг/день протягом вагітності спричинило мертвонародження та внутрішньочерепні крововиливи. Солі метилртуті викликали неврологічні розлади та затримку росту в потомства щурів, які отримували 10 мг/кг/день перорально протягом вагітності та загибель плодів/новонароджених кошенят, які отримували дози 5 або 10 мг/кг/день протягом вагітності. Сполуки етилртуті спричинили розщілину піднебіння у мишей після підшкірного застосування дози 10 мг/кг на 40 день вагітності; атаксію і гіпоплазію мозочка після лікування вагітних кішок дозою 2-3 мг/кг протягом вагітності. Застосування метилртуті вагітним щурам з питною водою в дозі 25 ppm (частин на мільйон, parts per million) призводило до зменшення ваги плодів, але не підвищувало частоту вад розвитку. Хлорид метилртуті, застосований перорально вагітним мишам спричинив вади розвитку, включаючи розщілину піднебіння, на фоні дози 2,5 мг/кг/день, частота вроджених вад розвитку зростала з підвищенням дози. Рівень життєздатності ембріонів/плодів знижувався при дозі 6 мг/кг/день. Чутливість плодів мишей до летальності та вад розвитку від метилртуті варіює в залежності від штаму тварин та часу впливу.
Щури не продемонстрували несприятливого впливу на розвиток після застосування дози 2,5 мг/кг/день та проявили залежне від дози підвищення частоти вад розвитку при дозах 5,0 та 7,7 мг/кг/день. Вади розвитку включали розщілину піднебіння, гідроцефалію та ураження головного мозку, яке характеризувалося як зміни білої речовини. Інтраперитонеальне застосування вагітним хом’якам дози 4 або 8 мг/кг одноразово при вагітності спричиняло смерть матерів чи плодів та деякі вади розвитку в потомства, яке вижило. Застосування дози 2 мг/кг/день протягом ембріонального розвитку також спричинило смерть та вади розвитку плодів. Ці старіші дослідження проаналізували вади розвитку, беручи до уваги плід без оцінки впливу на весь послід. Застосування кіновару (сульфіду ртуті) в дозі 10 мг/кг/день через зонд у мишей протягом вагітності, лактації та ще 7 тижнів після відлучення від матері призводило до зменшення посліду та ваги потомства (дослідження охопило 2 покоління). Потомство, яке піддавалось впливу кіновару лише протягом вагітності та лактації, мало підвищену активність у відкритому польовому тесті, збільшення тривалості сну після застосування барбітуратів та підвищення слухового порогу.
Вагітні щури, які отримували хлорид ртуті у питній воді в дозах 50 ppm та 100 ppm не пили таку кількість води, як тварини з контрольної групи і проявили зміни поведінки. Потомство продемонструвало затримку в набутті рефлексів новонароджених, а вплив на матерів найвищої дози асоціювався із зменшенням набирання ваги новонародженими. Дослідження щодо щоденного впливу на вагітних мавп саймірі (білячі мавпи) парів ртуті показало несприятливі ефекти розвитку, включаючи аборти, смертність новонароджених, зменшення ваги головного мозку, структурні аномалії. Деталі щодо токсичності ртуті для матерів не були надані і це не дає можливості оцінити вплив на потомство. Ці дослідники в 2000 році описали розповсюдження ртуті в тканині мозку матерів та плодів саймірі внаслідок впливу під час вагітності. Наслідки впливу ртуті через пари були виявлені в потиличній частці кори та в мозочку, розподіл ртуті в мозку плодів був таким самим як в дорослих мавп. Потомство саймірі піддали впливу ртутних парів інгаляційно дозою 0,5 або 1,0 мг/м3 і тренували натискати важіль за винагороду. Тварини з впливом та без були здатні навчитися натискати важіль, але тварини з групи впливу виявили більшу мінливість в тривалості цього завдання. Проте дослідження не деталізувало дози впливу на мавп та інші обставини. У щурів пероральне застосування хлориду ртуті протягом вагітності та лактації до рівня 1,6 мг/кг/день не спровокувало виникнення вад розвитку, хоча вага у потомства була зниженою. Відчуття дотику, зору та слуху не були порушені при цьому.
Інформація щодо впливу на плід:
Органічна ртуть.
В середині 1960 років спалах дитячого церебрального паралічу (ДЦП) та мікроцефалії серед новонароджених в рибальському селі в затоці Мінамата в Японії було пояснено вмістом метилртуті в рибі цієї затоки. Після цього інциденту, інтоксикація органічною ртуттю плода отримала назву хвороба Мінамата. Діти, які були вражені, мали судоми, когнітивні порушення, ДЦП, який характеризувався атаксією, атетозом та дизартрією. Патологія головного мозку у фатальних випадках проявлялась атрофією кори мозку та мозочка. Комп’ютерна томографія дорослих віком 20 років, які народились з хворобою Мінамата продемонструвала лише мінімальну або помірну кортикальну атрофію, атрофію мозочка та розширення шлуночків.
В Іраку, після того як зерно, забруднене метилртуттю помилково використали для випікання хліба, у новонароджених, які піддалися впливу внутрішньоутробно, діагностували психомоторну затримку та ДЦП. Аналогічне вроджене неврологічне захворювання повідомили в інших випадках забруднення їжі метилртуттю. Дослідження серед новонароджених та семирічних дітей на Фарерських островах визначило когнітивний дефіцит, асоційований з впливом на матерів при вагітності метилртуті при споживанні м’яса океанічних ссавців. Клінічне та нейропсихологічне тестування 814 індивідів з Фарерських островів у віці 22 років повідомило про дефіцит мовного розвитку, асоційованого з концентрацією ртуті в пуповинній крові (визначалась в пологах). Цей дефіцит був виявлений іншими тестами, але знайдені дані не були статистично значимими. На відміну від цього, не виявлено несприятливого впливу на когнітивну функцію дітей до віку 19 років при споживанні риби матерями на Сейшельських островах. Різниці в результатах між цими дослідженнями не було визначено, але їх можна пов’язати з впливом ртуті або іншими особливостями дієти.
Ссавці, які живуть в океані, мають більший рівень вмісту ртуті, аніж риба і можуть також містити інші забруднюючі речовини, такі як поліхлоровані біфеніли. Споживання океанічних ссавців на Фарерських островах не є частим явищем, в той час як на Сейшельських островах вони є постійним компонентом дієти. Інтегративні аналізи результатів IQ на Фарерських островах, Сейшелах, а також інше дослідження в Новій Зеландії дійшли висновку, що зниження рівня IQ на 0,18 в дітей відповідає кожній ppm зростання вмісту ртуті у волоссі матері. Не зовсім зрозуміло, як ці результати можна застосувати в рекомендаціях по дієті. Дослідження в інших популяціях також відзначили асоціацію між впливом ртуті в пренатальному періоді та можливим зростанням ризику затримки неврологічного розвитку.
Дослідження 2012 року припустило, що вміст ртуті у волоссі матерів асоціювався у хлопчиків з синдромом дефіциту уваги з гіперактивністю**, однак споживання риби в період вагітності протидіяло цьому очевидному ефекту.
|
**Синдром дефіциту уваги і гіперактивності (СДУГ; Attention–Deficit/Hyperactivity Disorder (ADHD) — неврологічно-поведінковий розлад розвитку, що починається в дитячому віці. Проявляється такими симптомами, як труднощі концентрації уваги, гіперактивнсть і погано керована імпульсивність. |
Дослідження 2014 року серед 230 пар мама-немовля з Сейшельських островів не виявило зв’язку між впливом ртуті в пренатальний період (визначено у волоссі матерів в пологах) та вагою новонароджених.
Риба.
Вся риба містить деяку частку метилртуті, але часте споживання сильно забрудненої риби може призвести до концентрації метилртуті у волоссі між 10 і 50 ppm. У 1971 році рівень 50 ppm у волоссі визначався як найнижчий рівень токсичності і тому ВООЗ прийняла коефіцієнт безпеки 10 для гіпотетично найбільш уразливих популяцій. Таким чином, концентрація 5 ppm у волоссі встановлена як верхня межа за міжнародним стандартом.
Популяційне дослідження в США, беручи до уваги 163 парні зразки пуповинної крові та крові матерів, виявило, що середній вміст ртуті у пуповинній крові був більш, ніж вдвічі вищим за рівень в крові матерів, вміст ртуті в обох зразках крові був підвищений у жінок, які вживали рибу або морепродукти протягом вагітності.
Епідеміологічні дослідження вивчали питання, чи споживання риби несприятливо впливає на розвиток.
Довготривалі дослідження в популяції Сейшельських островів, де споживають велику кількість океанічної риби, яка містить ртуть в кількості, аналогічній кількості, яка виявляється в рибі на ринку США, не виявило несприятливого впливу на неврологічний розвиток, пов’язаного із споживанням риби; дітей спостерігали до 9 років.
В 2006 році статистична оцінка зв’язку між вмістом ртуті у волоссі матерів одразу після народження дитини та результатами тестування дітей у віці 9 років визначила, що концентрація 20 ppm у волоссі матері відповідає 10 % можливості зниження результатів тестування. Автори цього повідомлення дійшли висновку, що ця оцінка була близькою до оцінки за результатами досліджень на Фарерських островах та в Новій Зеландії, включаючи вплив ртуті при споживанні м’яса акули, в яких орієнтовна доза, вирахована за вмістом у волоссі матерів в межах 7-10 ppm.
Дослідження з Тайваню припустило, що споживання риби дітьми після народження може бути важливішим фактором, ніж пренатальний вплив ртуті на результати мовного тестування.
В 2014 році дослідники з Китаю знайшли статистично істотну асоціацію між вмістом ртуті в пуповинній крові та результатами неонатального поведінкового неврологічного тестування. Вища концентрація в пуповинній крові та крові матері була пов’язана з вищим рівнем споживання риби, за повідомленнями жінок.
Концентрація ртуті в пуповинній крові була пов’язана з нижчим рівнем IQ в дітей інуїтів (етнічна група корінних народів Північної Америки) віком 8-14 років. Докозагексаєнова кислота, яка також міститься в рибі, зменшує негативний вплив ртуті.
Невелике дослідження в Каліфорнії у 2014 році не виявило статистично значимої асоціації між концентрацією ртуті в материнській крові в середині вагітності чи концентрацією ртуті у крові немовлят та розладами спектру аутизму. Концентрація ртуті в крові матері була вищою серед випадків розладу спектру аутизму ніж в загальній популяції.
В 2015 році не виявили асоціації між сукупним впливом метилртуті та ризиком аутизму (співвідношення шансів 0,95, 95% ДІ 0,95-1,12) чи затримки розвитку (1,00, 95% ДІ 0,89-1,13).
В більшості штатів США запроваджено поради щодо типу чи кількості споживання риби, зазвичай рекомендації полягають в обмеженні споживання риби жінками репродуктивного віку.
FDA та Агенція із захисту довкілля (Environmental Protection Agency, EPA) сумісно у 1990 роках та на початку 21 століття видали поради для споживачів: вагітних жінок, жінок, що можуть завагітніти, матерів, які годують немовлят грудним молоком, маленьких діток щодо обмеження споживання океанічної риби (акули, риби-меч, королівської макрелі, гребнеголова, тунця) чи місцевої риби до кількості одного прийому їжі або 350 грам (0,75 фунтів) на тиждень. У 2003 році об’єднаний експертний комітет з харчових добавок ФАО / ВООЗ (JECFA) також зменшив рекомендований щотижневий прийом риб-хижаків (риби-меч та акули) під час вагітності через занепокоєння щодо залишкового вмісту метилртуті в них. Як альтернативний варіант для отримання поживних речовин з риби FDA запропонувало молюсків, маленьку океанічну рибку та вирощену на фермах рибу. В 2014 році FDA та EPA проголосили про перегляд своїх рекомендації для включення 2-3 порцій риби в раціон щотижня. В 2014 році редактор припустив, що лосось, сайда/минтай та кальмар є джерелами корисних омега-3 жирних кислот з найнижчим вмістом ртуті. Через варіабельний вміст ртуті в рибі канадські вчені запропонували визначення ртуті у волоссі як метод моніторингу ртутного навантаження до вагітності у жінок, які повідомляють про часте споживання риби.
Оновлені рекомендації FDA щодо споживання риби при вагітності: різні види риби поділено на категорії по безпечності і надаються рекомендації по кількості прийомів на тиждень – «рибна діаграма» -Fish Chart.
Неорганічна ртуть.
В ранні 1990 роки, лікування сифілісу при вагітності за допомогою солей ртуті асоціювалося з абортами, однак не було визначено, що саме – ртуть чи сифіліс – викликали такі ускладнення.
Клінічний випадок: жінка успішно викликала аборт за допомогою 2500 мг хлориду ртуті, проте в неї розвинулась важка ниркова недостатність, жінка вижила.
В іншому клінічному випадку повідомляється про аборт у жінки на 14 тижні вагітності після того як у місці, де вона проживала розлилася ртуть. Рівень ртуті в жінки не визначався.
Окремі випадки повідомили про високий рівень впливу неорганічної ртуті на жінок протягом вагітності з нормальними результатами для дітей. В одному з таких випадків у жінки, яка працювала на фабриці з виготовлення ртутних термометрів, при вагітності в сечі виявлено в 40 разів вищу за верхню границю норми концентрацію ртуті. Вміст ртуті в її крові був в 10 разів вищим від норми, а у волоссі – в 100 разів вищим від норми. Концентрація ртуті в пуповинній крові була на 1% нижчою за концентрацію в материнській крові, хоча не ясно, чи вимірювання проводились одночасно. Інформація щодо новонародженого була обмеженою.
В іншому випадку вагітна жінка жила в зараженому будинку з концентрацією ртуті у повітрі 20-60 мг/м3. Виділення ртуті з сечею в цієї жінки було приблизно в 9 разів вищим за норму на 17 тижні вагітності і знизилось згодом. Дитина була здоровою у віці 2 роки.
У вагітної жінки на останніх строках вагітності була діагностована інтоксикація ртутними парами і призначено лікування пеніциламіном. Найвища концентрація ртуті в її крові сягала 25 мкг/дл. Вона народила здорову дитину через 26 днів при концентрації ртуті приблизно 3,8 мг/дл. Концентрація в крові новонародженої дитини була така сама як у матері.
Стоматолог з надмірним впливом ртуті через несправне обладнання при вагітності народила здорову дитину. Цей випадок не надає інформацію про рівень впливу ртуті на дитину.
Клінічний випадок: внутрішньовенне введення жінці рідкої ртуті (приблизно 3 мл) у ліктьову вену лівої руки. Цю вену видалили хірургічним шляхом, жінка проходила лікування (повторне хелатування) ще протягом року після цього випадку, однак концентрація ртуті в її крові та сечі продовжувала залишатися вищою, ніж на початку. Дев’ять років потому ця жінка пережила викидень на 8 тижні вагітності. Через 10 років після впливу ртуті вагітність протікала успішно без ускладнень до 37 тижня, коли виникло маловіддя, народилась здорова дитина з нормальним розвитком у 4 місяці. Концентрація ртуті в пуповинної крові і крові матері була однаковою.
Жінка, яка користувалася милом, що містить йодид ртуті мала підвищену концентрацію ртуті в крові та сечі так само як і її 3 місячна дитина. Так як мило ніколи не застосовувалося для дитини, передбачалося, що дитина була уражена трансплацентарно. Дитина мала розлад функції тубулярного апарату нирок, катаракту, мікроцитарну анемію, які визначалися авторами дослідження як наслідок впливу ртутної інтоксикації.
Стоматолог з надмірним професійним впливом ртуті народила дитину на 42 тижні вагітності, але дитина померла на 9 день життя; навколоплідні води були забруднені меконієм. Дитина мала мозкові порушення, але деталі не наводяться. Концентрація ртуті в крові дитини перед смертю була 16 мкг/л, яка на той момент вважалася нормою.
В Китаї дослідники визначали концентрацію в плаценті ртуті та інших елементів у 80 зразках, отриманих від дітей з дефектами нервової трубки та порівняли їх з концентрацією у 50 здорових новонароджених. Рівень ртуті в плаценті тих новонароджених, які мали дефект нервової трубки були набагато вищим.
Повідомляється про асоціацію з малістю для гестаційного віку при порівнянні вищого з нижчим тертилем концентрації ртуті в крові матері, що визначалось при вагітності (1,56, 95% ДІ 1,04-2,58). Вага та ріст новонароджених були негативно пов’язані в іншому дослідженні із рівнем загальної ртуті, метилртуті, неорганічної ртуті у волоссі матерів, плаценті, сечі, крові на момент пологів.
Дослідження в Туреччині проводилось у 2006-2007 роках на 3-10 дні після пологів. Повідомили про наявність ртуті у всіх зразках волосся новонароджених, 53% зразків грудного молока та в 2 зразках крові з пуповини. Концентрація ртуті у молоці та волоссі новонароджених не відрізнялась в залежності від кількості стоматологічної амальгами у матерів або споживання ними риби.
Стоматологічні амальгами.
Персонал стоматологічних клінік, який працює з амальгамами, що містять ртуть, може постійно знаходитись під впливом ртутних парів. В одному досліджені наведено порівняння, що концентрація ртуті у плаценті та мембрані плода в асистенток стоматологів була вдвічі вищою від тих, хто не був під таким впливом. Опитування британських стоматологів виявило зростання частоти спонтанних абортів; однак у анкетуванні приймала участь невелика кількість лікарів, контрольна група не була чітко визначна, повідомлена частота викиднів була низькою в обох групах. Не було інформації щодо уявного зростання викиднів, які були б асоційовані з впливом ртуті, анестетиків, або інших факторів.
Інше опитування з більшою кількість учасників та з конкретним запитом щодо діючої речовини, що містить анестетик та кількістю приготованих амальгам, не показало різниці частоти викиднів між жінками, які працюють асистентами та жінками чоловіків-стоматологів. Порівняння в цьому дослідженні проводилось між низьким рівнем впливу ртуті, визначеного як приготування 0-40 амальгам на тиждень та високим рівнем впливу, визначеного як приготування більш ніж 40 амальгам на тиждень.
Дослідження з Данії також не змогло показати зростання частоти спонтанних абортів серед асистентів стоматологів в порівнянні з контрольною групою.
В дослідженні серед жінок, асистентів стоматологів, яке оцінювало асоціацію між впливом закису азоту та спонтанними абортами, інформація щодо стоматологічних амальгам також враховувалась. Вплив від приготування понад 50 амальгам на тиждень асоціювали з відносним ризиком 1,8 (95 % CI 1,0-3,2) спонтанних абортів.
Одне з опитувань охопило 43 випускниць стоматологічної школи-інтернату та 32 не стоматологічних медсестер і не знайшло різниці у результатах вагітностей, проте цифри були невеликими.
Дослідження випадок-контроль щодо самовільного переривання вагітностей серед стоматологічних працівників ідентифікувало випадки і виділило контролі, використовуючи реєстр виписки з лікарні та реєстр народжень. Вплив визначався за допомогою анкетування, учасників поділили на категорії згідно кількості амальгам виготовлених за тиждень. Автори дослідження зазначили, що існувало ледь помітне підвищення ризику викиднів, асоційоване з більшою кількістю приготування амальгам, але жодне з цих порівнянь не було статистично значимим. Для порівняння, дослідження з Польщі визначало вплив ртуті у 81 жінки-стоматолога та асистента стоматолога на основі аналізу волосся голови та лобка.
Інформація щодо результатів вагітностей 51 жінки-стоматолога, яка до цього мала хоча б одну вагітність, отримувалась за допомогою анкетування. Контрольну групу становили жінки без впливу, але параметри відбору до контрольної групи не наведені. Репродуктивні невдачі визначалися за сумою спонтанних абортів, мертвонароджень, дітей з вродженими вадами розвитку і позитивно асоціювалися з концентрацією ртуті у волоссі. Не проводилось корекції на вік матері, паління, вживання алкоголю. На одних і тих самих жінок впливають різні несприятливі фактори, які вірогідно впливають на статистичний аналіз.
Доступні джерела не відзначають асоціацію ртуті з підвищенням частоти вроджених вад або неврологічних наслідків у нащадків стоматологів чи їх асистентів. Дослідження у дорослих синів жінок-стоматологів чи жінок-асистентів стоматологів не показало зниження рівня когнітивного тестування в порівнянні з синами жінок-лікарів чи не стоматологічних медичних сестер. Ці сини народилися в 1960 чи 1970 роки, коли вплив на працівників стоматологічних установ вважався високим.
Ртуть може вивільнятися з амальгамних стоматологічних наповнювачів як тільки вони потрапляють до рота. Дослідження в овець та щурів прицільно вивчали трансфер ртуті до плоду від матерів з амальгами. Найвищу концентрацію ртуті в плоду від впливу амальгами в матері знайдено в печінці та гіпофізі. Ні материнські, ні плодові токсичні наслідки не асоціювались з ртуттю, вивільненою з великої кількості амальгам, які були використані у дослідженні в овець.
У людини амальгамні наповнювачі асоціювалися з тимчасовим підвищенням концентрації ртуті у плазмі.
Використання моделі штучного рота для відтворення процесу жування та чищення однією групою вчених виявило, що зі свіжих амальгамних наповнювачів може вивільнитися ртуть 0,3-0,4 мкг/день, але цей показник знижується до менш, ніж 0,05 мкг/день після 30 днів.
Два дослідження розглянули ймовірність впливу ртуті із стоматологічних амальгам на неврологічний розвиток.
Свинець, марганець та ртуть були виявлені в емалі запломбованих молочних зубів у дітей з розладами спектру аутизму або гіперактивною поведінкою в порівнянні з дітьми з нормальним розвитком. Не виявлено істотної різниці між цими групами.
В когортному дослідженні 300 вагітних жінок з Сейшельських островів (дослідження харчування дітей) кількість материнських амальгам не асоціювалась з несприятливим впливом на неврологічний розвиток дітей, обстежених в 9 та 30 місяців або 5 років життя.
Хоча дослідження в експериментальних тварин не показало несприятливих ефектів від амальгам, які містять ртуть, на плід, декілька вчених припустили, що використання амальгам, які містять ртуть для реставрації зубів потрібно уникати в період вагітності та в дитинстві, щоб зменшити непотрібний вплив ртуті на ранніх стадіях розвитку центральної нервової системи.
Державна служба охорони здоров’я переглянула безпечність використання стоматологічних амальгам, результати досліджень в овець і дійшла наступного висновку: «доступні дані не відповідають такій обмежувальній політиці». Інші коментатори закликали застосувати загальні обмеження, вироблені на основі досліджень в овець, у медичній практиці.
Від пізніх 1980 років німецькі і шведські департаменти охорони здоров’я не рекомендували застосовувати відновлення зубів за допомогою амальгам вагітним жінкам чи дітям до 6 років. Більш сучасне німецьке дослідження знайшло зв’язок між кількістю застосованих амальгамних наповнювачів у матерів та концентрацією ртуті в органах плоду. Ці дослідники рекомендували обмежити використання амальгам у дівчат та жінок дітородного віку.
На противагу цьому, рандомізоване дослідження щодо стоматологічних амальгам або вільних від ртуті сполук у дітей віком 6-10 років не виявило несприятливих ефектів впливу ртуті на когнітивний і моторний розвиток.
Застосування препарату під час вигодовування:
В овець продемонстровано вихід ртуті з амальгами до молока.
Концентрація ртуті в молоці людини асоціювалась з кількістю амальгами у матері.
Німецькі дослідники вивчали можливі джерела ртуті у немовлят, які знаходяться на грудному вигодовуванні, і дійшли висновку, що кількість ртуті в молоці невелика, тому переваги грудного вигодовування перевищують ризик навіть у жінок з великою кількістю таких наповнювачів з вмістом ртуті.
Метилртуть була первинною формою ртуті, яку знайшли в грудному молоці в Японії у дослідженні 2015 року.
В дослідженні 182 дітей з Фарерських островів подвійна концентрація ртуті в пуповинній крові асоціювалась із зниженою вагою у 18 місяців, всупереч відсутності впливу на вагу при народженні. Новонароджені, які знаходились на грудному вигодовуванні, мінімум 18 місяців, були меншими від тих, які не годувалися грудним молоком, це пояснювалося ефектом впливу ртуті. Незважаючи на вплив ртуті при вагітності та через молоко, додаткові дані, отримані від дослідження цієї популяції не свідчать про дефіцит нейропсихологічних показників у віці 7 років.
Концентрація ртуті в еритроцитах новонароджених, чиї матері піддалися впливу метилртуті через споживання морепродуктів, знижувалась в наступні 3 місяці грудного вигодовування. Автори дійшли висновку, що ртуть не дуже ефективно впливає через грудне молоко.
Вплив на фертильність (чоловіків та жінок):
У жіночої статі.
Інгаляційний вплив на щурів ртутних парів дозою до 2 мг/м3 по 2 год/день протягом 5 днів викликало зміну циклічності еструсу, проте не було впливу рівень вагітності чи імплантації.
Інше дослідження серед мишей виявило, що пероральний вплив хлориду ртуті дозою 0,25-1,0 мг/день при спарюванні, вагітності та лактації викликав несприятливі наслідки для фертильності та показників виживання потомства.
У самок щурів з пероральним впливом хлориду ртуті дозою до 2 мг/кг/день протягом 60 днів попередньо до спарювання було менше імплантацій, більше невдалих імплантацій на 13 день вагітності, нижча концентрація прогестерону, вища концентрація лютеїнізуючого гормону.
Дослідження у жінок-асистенток стоматологів не показало зменшення фертильності, асоційованого з впливом ртуті.
В чоловічої статі.
Самці щурів отримували хлорид ртуті маленькими дозами протягом 30 днів, виявлено значно понижений рівень продукції сперми та аномальну морфологію сперматозоїдів.
Два дослідження можливих ефектів впливу ртуті на батьків [чоловіків] припустили підвищений ризик викиднів у жінок цих чоловіків. Однак, жодне із досліджень не змогло адекватно прогнозувати можливі безпосередні ефекти впливу ртуті на матір або професійний вплив, залишаючи це питання не вирішеним.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Сайт “MotherToBaby – a service of the Organization of Teratology Information Specialists (OTIS)” (http://www.mothertobaby.org/).
Адаптовано 06.06.2018 р:
Перекладач – К.В. Колядко.
Перевірено – Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 07.06.2018 р.
РЕЗВЕРАТРОЛ
Група/призначення:
Природний фітоалексин* та поліфенол. Виробляється кількома рослинами за умови інфекції бактеріями або грибами (міститься в шкірці червоного винограду**, червоному вині, виноградному сокові, чорниці, малині, арахісі, тощо). Червоне вино має найвищий вміст резвератролу (0,1-15 мг/л), в порівнянні з білими та рожевими винами.
Резвератрол міститься в продукті китайської традиційної медицини Ху Чжан (Hu Zhang), який складається з висушених корінців і кореневищ Polygonum cuspidatum.
Резвератрол також може бути отриманий за допомогою хімічного синтезу та доступний як біологічно активна добавка. Вважається антивіковим продуктом.
|
*Фітоалексини – це антибактеріальні та протигрибкові речовини, що виробляються рослинами у відповідь на інфекцію патогенівю. **Екстракт шкірки червоного винограду є джерелом антиоксидантів, включно з резвератролом, підвищує ендотеліальну продукцію оксиду азоту. При моделюванні пре еклампсії у щурів шляхом пригнічення синтази оксиду азоту екстракт шкірки червоного винограду інгібував розвиток гіпертензії. При введенні щурам в період лактації з харчуванням екстракту шкірки червоного винограду в дозі 200 мг/кг/день у потомства в дорослому віці не розвивалась гіпертензія, ожиріння, концентрація в плазмі тригліцеридів та глюкози, резистентність до інсуліну, що спостерігали у потомства тварин з високо жировою дієтою без екстракту шкірки червоного винограду. Відсутня інформація щодо людини |
Резвератрол існує у вигляді цис- та транс- ізомерів. Синтетичний транс-резвератрол інколи використовується в якості харчової добавки замість натурального продукту. В людини резвератрол легко абсорбується при пероральному прийомі, але має низьку біодоступність через метаболізм та швидку екскрецію. Метаболіти резвератролу кон’югуються з сульфатами та глюкуронідами, ці метаболітиі можуть бути відповідальними за ефекти in vivo. Окрім того, знижені кон’югати дигідрорезвератролу та полярні невідомі продукти можуть містити 50% пероральної дози резвератролу і сприяти ефектам. Резвератрол використовується як місцевий антиоксидант.
Більшість опублікованих досліджень повідомляють про діапазон потенційно корисних ефектів резвератролу, а саме кардіоваскулярних, антиоксидантних, прооксидантних, метаболічних при діабеті ІІ типу, антионкогенних, антидепресивних, нейропротективних, протизапальних, але ці дані в основному отримані від лабораторних тварин чи в дослідженнях in vitro. Невелика кількість клінічних досліджень наводить суперечливі результати при використанні пероральних доз 300-1000 мг в день протягом багатьох тижнів. Деякі очікувані корисні наслідки споживання червоного вина вважаються викликаними резвератролом, а саме кардіоваскулярні можуть асоціюватися з самим алкоголем. Жінкам вагітним або тим, що можуть завагітніти не рекомендовано пити червоне вино чи інші алкогольні напої.
Альтернативні назви / синоніми: ресвератрол.
Діюча речовина: 3,5,4′-тригідроксистилбене.
Рекомендації при вагітності:
Не рекомендуються харчові добавки з резвератролом в період вагітності.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Стандартні тератологічні дослідження не проводились.
Інформація щодо досліджень на тваринах:
При введенні вагітним щурам резерватролу з дієтою (4000 мг/кг) з 0,5 дня вагітності до 21 постнатального дня не було виявлено несприятливого впливу на тривалість вагітності, вагу плодів, вагу плаценти, відносну до ваги тіла вагу органів. Немає інформації про можливі аномалії плода. На 21 постнатальний день спостерігали зниження ваги дитинчат на 17%, проте, невідомо, чи це було наслідком пренатального або постнатального впливу резвератролу. Не відзначали різницю ваги тіла в потомства у віці 5 тижнів життя. Лікування матерів резвератролом також попереджало розвиток гіпертензії в потомства в дорослому віці. Синтетичний транс-резвератрол не призводить до несприятливих наслідків при дослідженні ембріо-фетальної токсичності у щурів на фоні дози 750 мг/кг/день.
При годуванні вагітних мавп дієтою західного стилю з 36% жировими добавками з 0,37% резвератролу виникало 30% зниження ваги матерів, покращувалась толерантність до глюкози, збільшувався об’єм кровотоку в матковій артерії в порівнянні з групою мавп, яких годували високожировою дієтою. Підвищувалась частота запалення плаценти та накопичення тригліцеридів у печінці, маса підшлункової залози плода збільшувалась на 42%. Виходячи зі змін підшлункової залози плодів автори вважають, що жінкам не слід приймати харчові добавки резвератролу в період вагітності.
Дослідження у мишей при вагітності та в період лактації з дієтою з високим вмістом жиру виявило, що додавання резвератролу (0,2% w/w) сприяло розвитку коричневих та бежевих адипоцитів та попереджало ожиріння в потомства чоловічої статі. У самок щурів дози резвератролу 0,5-2 мг/кг, введені внутрішньовенно, пригнічували скорочення матки, індуковане простагландином F2 альфа та калію хлоридом та скорочення, стимульовані активатором кальцієвого каналу.
При годуванні вагітних макак дієтою з високим вмістом жиру з або без 0,37% резвератролу, ця добавка підвищувала поглинання плацентрою докозагексаєнової кислоти (поліненасичена жирна кислота (ПНЖК) класу Омега-3). Додавання вагітним щурам з харчуванням 4000 мг/кг резвератролу на 7-21 дні вагітності попереджувало загибель плода при гіпоксичній вагітності (8,5%). В цьому дослідженні продемонстровано проникнення резвератролу через плаценту. Про моделюванні прееклампсії у щурів призначення резвератролу не знижувало кров’яного тиску (доза резвератролу не наводиться). Годування вагітних щурів дієтою з низьким вмістом протеїну продемонструвало часткове попередження несприятливих наслідків для матерів та плодів (підвищення рівнів лептину та інсуліну) пероральним призначенням 20 мг/кг/день резвератролу протягом вагітності. Введення резвератролу на 14-19 дні вагітності мишам, лікованим на 14 день діоксином (2,3,7,8-тетрахлордибензо-пара-діоксином) 10 мкг/кг пом’якшувало імунотоксичні ефекти останнього.
Інформація щодо впливу на плід:
Відсутні повідомлення про вплив резвератролу на вагітних жінок та плоди. Проводилось дослідження на первинній культурі адренокортикальних клітин абортованих плодів на 10-12 тижнях вагітності, яке виявило пригнічення синтезу дегідроепіандростерону, андростендіону та 11-дезоксикортизолу резвератролом як в активованих кортикотропіном клітинах, так і в неактивованих. Інші дослідження використовували плаценту людини та тканини міометрію при закінченій вагітності in vitro і виявили ряд потенційно захисних наслідків (ті, що присутні при діабеті та прееклампсії, вплив на пупкову вену, залежна від дози релаксація міометрію) при концентрації 1-100 мкМ. Клінічне значення цих отриманих in vitro знахідок невідоме.
Застосування препарату під час вигодовування:
Відсутня інформація про проникнення резвератролу до грудного молока людини та про вплив на немовля.
У щурів спостерігали затримку росту дитинчат при вигодовуванні, чиї матері отримували з харчуванням резвератрол, але механізм виникнення затримки розвитку невідомий. Дослідження in vitro продемонстрували, що резвератрол може порушувати синтез пролактину, хоча досліди на щурах з оваріектомією виявили, що введення резвератролу протягом 3 місяців в дозі 5-50 мкг/кг/день не впливає на секрецію пролактину. Щурам протягом всього періоду лактації вводили 5-100 мкМ резвератролу з питною водою, що призвело до наступних змін в потомства жіночої статі: зменшення ваги в дорослому віці, збільшення ваги яєчників; еструс та соціосексіальна поведінка були нормальними. В дорослих самців зменшувалась маса тіла та концентрація тестостерону в плазмі, підвищувалась вага яєчок, пригнічувалась соціосексуальна поведінка. Клінічне значення цих знахідок невідоме.
Вплив на фертильність (чоловіків та жінок):
Резвератрол зв’язується з рецепторами естрогену зі 1/700 спорідненістю до естрадіолу, альфа та бета рецепторів естрогену. Дослідження in vitro ракових клітин людини продемонструвало слабку естрогенну активність резвератролу. Основний метаболіт резвератрол-3-О-сульфат, який визначається в плазмі людини, проявив слабкий естрогенний агонізм та антагонізм в аналогічному тестуванні.
Дослідження іn vitro тестували клітини яєчників (CHO)-K1 китайських хом’ячків, показавши слабку антиестрогенову активність до естрогенових рецепторів альфа та бета і слабкий антагонізм до бета-рецепторів. Невідомо, чи такий агонізм та антагонізм до естрогенових рецепторів на фоні типового впливу резвератролу виникає у людини.
Повідомляється про очевидні захисні ефекти резвератролу для яєчників ссавців, ооцитів, чоловічих репродуктивних органів, сперматозоїдів в присутності хімічних агентів чи певних фізіологічних умов. Призначення акриламіду самцям мишей протягом 3 або 6 місяців в дозі 0,18 мг/кг/день призводило до пошкодження ДНК гермінативних клітин та зрілих сперматозоїдів, не впливаючи на фертильність, а додавання резвератролу в дозі 10 мг/кг/тиждень протягом 3 місяців пом’якшувало такий негативний вплив. Поширення лікування резвератролом на період понад 6 місяців у мишей, які отримують акриламід, призводило до передчасної активації вищеперерахованих клітин.
Дослідження у мишей з індукованим аденоміозом виявило, що резвератрол в дозі 2 чи 3 мг/кг пригнічував інфільтрацію міометрію, зменшував скорочуваність матки, понижував концентрацію в плазмі кортикостерону. Введення самкам мишей віком 2-3 місяців резвератролу з питною водою в дозі 30 мг/л (приблизно 7,0 мг/кг/день) протягом 6-12 місяців надавало їм здатність до репродукції у віці 12 місяців, чого не спостерігали в контрольній групі. Ліковані мишенята мали більші: пул фолікулів, теломеразну активність, довжину теломер, пов’язану з віком експресію генів у яєчниках, аналогічно молодим мишам.
Призначення резвератролу в дозі 1500 мг/день протягом 3 місяців жінкам з синдромом полікістозних яєчників призводило до 23,1% зменшення концентрації загального тестостерону в плазмі, 22,2% зниження дегідроепіандостерон сульфату, 31% зменшення інсуліну натще (fasting insulin), 66,3% підвищення чутливості до інсуліну в порівнянні з лікованою плацебо контрольною групою.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 11.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 12.07.2018 р.
БІСФЕНОЛ А
Група/призначення:
Хімічна речовина білого кольору. Широко використовується для одержання виробів із пластмаси, включаючи пластикові упаковки для продуктів харчування і напоїв, лінзи для окулярів, тощо. Це шкідлива речовина, в промисловості одержують методом конденсації фенолу з ацетоном в присутності різних каталізаторів, зокрема, кислот.
Агент може вимиватися з пластикових контейнерів для їжі та напоїв і стоматологічних герметиків. Визначається в зразках води та повітря. Однак, за рахунок короткого періоду напіврозпаду в повітрі, малоймовірним є поширення з точки знаходження.
На людину бісфенол А первинно впливає через їжу, після перорального проникнення більша його кількість в крові кон’югується з сироватковими білками. Елімінується з сечею у вигляді глюкуроніду. Період напіввиведення у людини менший за 6 годин.
Бісфенол А виявлявся в 92,6% зразків сечі 2517 учасників віком 6 років та старше у 2003-2004 (американське національне дослідження здоров’я та харчування). Агент був ідентифікований в термічному папері, який використовується в касових апаратах та в крові і сечі касирів.
Хоча бісфенол А може зв’язуватися з естрогеновими рецепторами, він має слабку естрогенну активність. Це пояснюється швидкою глюкуронідацією, а бісфенол А глюкуронід не має естрогенної активності.
Альтернативні назви / синоніми: бісфенол.
Діюча речовина:
Бісфенол А (4,4′-дигідрокси-2,2-дифенілпропан).
Рекомендації при вагітності:
Відсутня інформація про підвищений ризик вроджених вад розвитку.
Рекомендації при лактації:
Відсутня інформація про ризик для немовляти.
Прийом під час вагітності (короткий висновок):
Бісфенол А має слабку естрогенну активність. Виходячи з експериментів над тваринами не очікується підвищення ризику вроджених вад розвитку в людини. Екологічне дослідження асоціювало хромосомні та неврологічні аномалії у плодів з концентрацією вільного бісфенолу А в крові матері.
Інформація щодо досліджень на тваринах:
Плацентарний трансфер бісфенолу А продемонстровано у мишей, щурів, мавп, людини. Не спостерігали різниці в фармакокінетиці і метаболізмі бісфенолу А у вагітних та невагітних щурів. Проте деякі дослідники припускають, що використані штами щурів мають певну нечутливість до естрогену, що робить їх поганим вибором для тестування бісфенолу А, але експерти не підтримують цього твердження (NTP-CERHR Expert Panel). Концентрація бісфенолу А та бісфенолу А глюкуроніду була нижчою в плаценті щурів, ніж в плазмі або печінці матері. Інше дослідження у щурів повідомило, що концентрація бісфенолу А була вищою в плода в порівнянні з плазмою матері.
Добова доза 1000 мг/кг бісфенолу А протягом вагітності була токсичною для щурів та знижувала виживання плодів і ріст кісток, але не призводила до підвищення частоти вроджених вад розвитку. В цьому дослідженні доза 100 мг/кг/день протягом вагітності не чинила несприятливого впливу на матерів та потомство. Дослідження в 3 поколіннях щурів не виявило несприятливих наслідків при використанні дози до 50 мг/кг/день. Призначення дози 85 мг/кг/день вагітним щурам викликало підвищення частоти гідроцефалії та затримки розвитку в потомства, а введення 125 мг/кг запобігало вагітності в більшості тварин. Це дослідження було попереднім, без використання діапазону доз, як це прийнято в тератологічних дослідженнях. Інше дослідження у щурів також продемонструвало вищу частоту гідроцефалії та затримки осифікації в потомства лікованих тварин. Два формальні дослідження щодо токсичного впливу на розвиток виявили, що бісфенол А спричиняє токсичність в матерів та потомства мишей і материнську токсичність у щурів, але призводить до зростання частоти вроджених вад розвитку (дози до 640 мг/кг/день у щурів та до 1250 мг/кг/день у мишей). Повідомляється, що у мишей з пренатальним та постнатальним (до 30 дня) впливом через питну воду зростала середня вага жирової тканини та підвищувалась середня концентрація холестерину. Одне дослідження у мишей повідомляє, що призначення бісфенолу А при вагітності підвищує вагу чоловічих статевих органів в потомства, але інші дослідження цього не підтверджують. При деяких дослідженнях в результаті призначення бісфенолу А протягом вагітності зменшувалась концентрація в сироватці тестостерону в дитинчат чоловічої статі та порушувався сперматогенез. Дослідження у щурів припустило, що пренатальний вплив може призводити до збільшення числа клітин Сертолі в потомства чоловічої статі. Інші дослідження у щурів та мишей продемонстрували зниження виживання плодів, підвищення частоти резорбції плодів та/або зниження ваги тіла при народженні або в постнатальному періоді у випадку перорального впливу протягом всієї вагітності та/або лактації. Повідомляється, що пренатальний вплив на щурів індукував тонкі зміни молочних залоз, специфічні до часу та дози впливу. В цьому дослідженні також виявлено, що як низькі, так і високі дози бісфенолу А призводять до значного кластеру високо регульованих генів, пов’язаних з імунною системою. Ще одне дослідження у щурів з впливом на пізніх термінах вагітності та протягом лактації в дозах до 320 мг/кг/день не продемонструвало несприятливого впливу на подальшу репродуктивну поведінку у потомства жіночої статі чи вагу репродуктивних органів в обох статей. Дослідження, при якому вагітним мишам одного покоління перорально вводили агент від 11 дня вагітності до народження виявило істотну затримку початку першого еструсу в третьому поколінні (найвища застосована доза становила 50 мкг/кг/день). В третьому поколінні на фоні дози 0,5 та 50 мкг/кг/день відмічали затримку вагінального відкриття, чого не спостерігали при дозі 20 мкг/кг/день. Рев’ю 2007 року не виявило доказів на підтримку підвищення частоти вроджених вад розвитку при пренатальному впливі бісфенолу А при дозах до 640 мг/кг/день у щурів та до 1250 мг/кг/день у мишей. Також не підтримується зв’язок між впливом бісфенолу А при вагітності та порушенням фертильності у самок і самців на фоні доз до 450 мг/кг/день у щурів та 600 мг/кг/день у мишей. Не виявлено доказів зв’язку між впливом агенту та вагою простати при дозах до 475 мг/кг/день в дорослих щурів чи 600 мг/кг/день в мишей; зв’язку між бісфенолом А та зміною віку настання пубертату у самців чи самок (дози до 475 мг/кг/день). Оновлення цих даних у 2008 році в монографії NTP (National Toxicology Program, U.S. Department of Health and Human Services) спонукало висловити більшу стурбованість відносно потенційного впливу на розвиток людини.
Деякі дослідження у мишей та щурів припустили, що вплив бісфенолу А пренатально та/або при лактації може змінювати нейроповедінкові показники в потомства у підлітковому та/або дорослому віці. У мишей припускається підвищення ризику раку молочних залоз. У самок мишей відзначали однакову концентрацію бісфенолу А в крові після підшкірного та перорального введення.
Дослідження у щурів з пероральним впливом пренатально та в період лактації в дозах до 200 мкг/кг/день (4000-кратне до рівня впливу на людину) повідомляє про народження потомства без несприятливих наслідків для розвитку геніталій, пубертату, фертильності.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Плацентарний трансфер бісфенолу А продемонстровано у мишей, щурів, мавп, людини.
Дослідження 2008 року визначало концентрацію в крові бісфенолу А в 40 жінок на момент пологів, вона коливалась в межах 0,5-22,3 нг/мл. Не виявлено асоціації з порушенням тривалості гестації та вагою новонароджених, а в іншому дослідженні – з передчасними пологами. Ще одне дослідження повідомило про асоціацію між рівнем агенту в сечі матері та низькою вагою при народженні. Ці дані обмежувались потомством жіночої статі. Середня вага 17 новонароджених з концентрацією в амніотичній рідині 0,40-2,0 нг/мл була на 241,8 грам меншою від показника в немовлят з рівнем в амніотичній рідині нижчим від межі визначення (р=0,049).
Таким чином, бісфенол А виявляється в пуповинній крові та амніотичній рідині. Порівняння 101 жінки, якій проводилось переривання вагітності за медичними показами (аномалія плоду) з 50 вагітними контрольної групи не продемонструвало різниці між групами щодо концентрації загального бісфенолу А. Концентрація вільного бісфенолу А була вищою у жінок з групи переривання вагітності, хоча аномалії плодів були присутні за тижні до вимірювання концентрації в крові. Різницю між групами пояснили за рахунок жінок, плоди яких мали хромосомні аномалії (46%) та жінок, чиї плоди мали системні аномалії центральної та периферичної нервової системи (28%). Ці жінки були старшими за віком, ніж в контрольній групі. Стратифікація на вік 35 років демонструє стійке зростання вільного бісфенолу А у жінок, чиї плоди мали хромосомну аномалію в порівнянні з жінками, які носили нормальних плодів, але різниця не була статистично проаналізована.
Ретроспективне дослідження 2014 року з охопленням 115 жінок в академічному центрі плідності виявило, що визначена у терміні 4-5 тижнів концентрація бісфенолу А позитивно корелювала з вищим ризиком анеуплоїдії та самовільного переривання вагітності з еуплоїдними плодами (з нормальними каріотипами). Інше дослідження виявило вищий рівень в крові матерів некон’югованого бісфенолу А, якщо плоди мали вади центральної нервової системи або хромосомні аномалії. Не було асоціації з іншими вродженими вадами розвитку. Більшість або всі жінки були обстежені до переривання вагітності, що піднімає питання про контамінацію агентом в медичному закладі. Не було асоціації між концентрацією агенту в сечі матерів в І чи ІІІ триместрі та визначеними при ультразвуковому обстеженні або огляді новонароджених довжиною стегна, окружністю голови, окружністю живота, біпарієтальним розміром, вагою тіла.
Не спостерігали відмінностей концентрації бісфенолу А в плаценті при порівнянні вагітностей з гіпоспадією та крипторхізмом у плодів з контрольною групою. Однак, ймовірність ураження дітей була вищою при концентрації в плаценті в третьому тертилі, аніж в дітей, коли в плаценті бісфенол А не виявлявся (співвідношення шансів 7,23, 95% ДІ 1,48-35,46). Дослідження пренатального впливу бісфенолу А та фталатів у хлопчиків виявило асоціацію з адренархе (0,12-0,65) та пубертатом (0,50-0,98) у віці 8-14 років. Пренатальний вплив оцінювали за обстеженням, принаймні, одного зразка сечі матері в ІІІ триместрі з кількісним визначенням фталатів та метаболітів бісфенолу А. Концентрація в сечі при вагітності та в дитинстві асоціювалась з тривогою та гіперактивністю в дівчат, але після корекції на інші фактори тільки кілька моментів були статистично значимими. Інтерпретація цього дослідження була обмежена великою кількістю порівнянь. Інші дослідження, намагаючись асоціювати пренатальний вплив бісфенолу А з поведінковими проблемами потомства, отримали суперечливі результати, особливо якщо в основу аналізу ставилась стать дитини.
Застосування препарату під час вигодовування:
Повідомляється про трансфер бісфенолу А до молока у гризунів. У щурів стале співвідношення концентрації молоко : сироватка становило 2,4-2,7. Одне повідомлення інформує про визначення бісфенолу А в грудному молоці людини, рівень вільного бісфенолу А становив до 6,3 мкг/л в 12 зразках (в середньому 0,4 мкг/л). Пероральне введення мишам в період лактації дози 300 мг/кг/день призвело до порушення якості сперми в потомства чоловічої статі в дорослому віці. Дослідження з вивчення зразків молозива 101 жінки в Японії виявило концентрацію на рівні 1-7 нг/мл (в середньому 3,41 (0,13) нг/мл). Оскільки автори не виявили кореляції між концентрацією бісфенолу А та віком матері, вони припустили малу ймовірність акумуляції бісфенолу А в організмі.
Вплив на фертильність (чоловіків та жінок):
Дослідження при безперервному розведенні мишей з додаванням 0,5% бісфенолу А до дієти виявило зменшення живих дитинчат на послід та посліду на спарених мишей. Репродуктивне дослідження в 2 поколіннях щурів з використанням дози до 200 мкг/кг/день не продемонструвало істотного впливу на потомство. Досліджувались інші репродуктивні наслідки на фоні вищих доз або ін’єкційного введення (таке введення не стосується людини), такі як збільшення ваги простати та препуціальних залоз, зменшення ваги придатків і продукції сперми у самців, а у самок – порушення розвитку статевих органів і скорочення часу до статевого дозрівання. Повідомляється, що бісфенол А не спричиняє рак простати у щурів (дози до 148 мг/кг/день) чи мишей (до 600 мг/кг/день) при впливі в дорослому віці. Інші дані свідчать про відсутність порушення фертильності у мишей при дозах до 600 мг/кг/день. Однак, при примусовому введенні дорослим щурам через зонд протягом 40 днів дози 5 мг/кг/день знижувались рівень фолікулостимулюючого гормону, продукції сперми, резерв сперми.
Фертильність у людини.
Дослідження в чоловіків в репродуктивній клініці описало припущені тренди, пов’язані з концентрацією бісфенолу А в сечі та зниженням концентрації сперми, зміною морфології та пошкодженням ДНК сперматозоїдів. Однак, тільки невелика кількість повідомлених змін була статистично значимою. Китайська стаття повідомляє про зворотну кореляцію бісфенолу А в сечі з концентрацією сперми у чоловіків з або без професійного впливу бісфенолу А. Морфологія сперматозоїдів не залежала від рівня агенту. Частота субфертильності та аномальних спермограм була низькою. Аналіз 2010 року показників сперми та концентрації в сечі бісфенолу А в групі 375 чоловіків не виявив істотної асоціації за винятком маркерів вільного тестостерону. Автори дійшли висновку, що у фертильних чоловіків будь-який вплив невисокої концентрації бісфенолу А із зовнішнього середовища на репродуктивну функцію є, ймовірно, малим та без клінічного значення. Аналіз групи чоловіків (2015 рік), які проживають в штатах Мічиган та Техас, виявив асоціацію між рівнем бісфенолу А в сечі та якістю сперми. Концентрація агенту негативно асоціювалась з фрагментацією ДНК сперматозоїдів, припускаючи захисний ефект. Дослідження 2016 року серед 191 чоловіка з різним ступенем плідності повідомило, що рівень бісфенолу А в сім’яній рідині, але не в плазмі, негативно асоціювався з концентрацією сперми (r=-0.198;p=0.009), кількістю сперматозоїдів (r=-0.178;p=0.018), морфологією (r=-0.160;p=0.044). Два повідомлення цього ж дослідження щодо групи чоловіків з професійним впливом бісфенолу А відзначили залежні від дози несприятливий вплив на сексуальну функцію. Дисфункція включала зниження лібідо, еректильні та еякуляторні труднощі, невдоволення сексуальним життям. Перехресне дослідження у чоловіків з професійним впливом бісфенолу А виявило зворотній зв’язок між концентрацією агенту та концентрацією андростендіону та вільного тестостерону. На ці зміни могло вплинути підвищення рівня секс зв’язуючого глобуліну.
Професійне когортне дослідження в групі синів працівників з або без впливу бісфенолу А при вагітності визначало аногенітальну відстань. 56 хлопчиків зазнали такого пренатального впливу, а батьки 97 не мали такого впливу. Вплив бісфенолу А визначали за описом професії, це було пов’язано зі зменшенням аногенітальної відстані (від середньої точки ануса до передньої основи пеніса). Асоціація була статистично значимою для материнського, але не батьківського впливу.
Повідомлення 2017 року описало зворотну асоціацію між концентрацією бісфенолу А в І триместрі в матері та одним показником аногенітальної відстані у новонароджених дівчат (анус-клітор), але значення іншого показника (анус-вуздечка статевих губ) не було істотним. Інше дослідження інформує про зменшення аногенітальної відстані у новонароджених хлопчиків з вищим рівнем в пуповинній крові бісфенолу А і відсутність таких змін у дівчат.
У жінок, які звернулись в репродуктивну клініку, продемонстровано зворотну асоціацію між концентрацією бісфенолу А в сечі та кількістю астральних фолікулів, але відсутність зв’язку з об’ємом яєчників чи концентрацією фолікулостимулюючого гормону в сироватці на ранній фолікулярній фазі. Дослідження у вагітних жінок не виявило зв’язку між концентрацією бісфенолу А в сечі в І триместрі та самоповідомленням про час настання вагітності (оцінка плідності). Дослідження серед жінок перед екстракорпоральним заплідненням не виявило асоціацій з рівнем бісфенолу А в сечі, зібраній до проведення пошуку ооцитів та імплантації, клінічною вагітністю, рівнем народжених живими. Потовщення ендометрію непослідовно асоціювалось з концентрацією бісфенолу А в сечі з позитивною асоціацією у жінок до 37 років та негативною у жінок 37 років та старших.
Рев’ю 2009 року від контрактної консалтингової фірми дійшло висновку, що низький рівень впливу, типовий для бісфенолу А, з малою ймовірністю несприятливо вражає репродуктивне здоров’я та розвиток людини. А рев’ю 2014 року надало протилежний висновок.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 09.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 10.07.2018 р.
ФІТОЕСТРОГЕНИ
Група/призначення:
Це різнорідна група природних нестероїдних рослинних сполук, які завдяки своїй структурі, подібної до естрадіолу, можуть викликати естрогенний та (або) антиестрогенний ефект. Містяться в тваринних кормах, особливо конюшині та сої. Людина отримує фітоестрогени від споживання рослинних продуктів або з тваринними продуктами з попереднім впливом фітоестрогенів.
Найвищий рівень споживання ізофлавонів в раціоні звичайно є у споживачів, які приймають дієтичні добавки, що містять фітоестрогени (±40-100 мг/день), неонатальні суміші на основі сої (±40 мг/день), у веганів (±75 мг/день) та споживачів традиційної південно-східної азійської дієти (±25-100 мг/день). Середній рівень споживання ізофлавонів у європейців та вегетаріанців значно нижчий (±1–2 мг/день та ± 3-12 мг/день, відповідно).
Barnes (2003) критично проаналізував доступні дослідження щодо впливу фітоестрогенів і дійшов висновку, що пероральну дозу ізофлавону 50 мг/день (±0,7 мг/кг мт/день (маси тіла на день) слід вважати безпечною для більшості популяцій. Також допустимим є підвищення ліміту безпечності до 2 мг/кг мт/день в клінічних дослідженнях при ретельному моніторингу учасників.
При розрахунках на основі ваги новонароджених соєві суміші для немовлят містять найбільше ізофлавонів (±4-8 мг/кг мт/день). Це вище за попередньо зазначену безпечну дозу (Barnes). Доказів несприятливого впливу соєвих сумішей на функцію щитоподібної залози немовлят недостатньо. Проте стурбованість щодо потенційного ризику існує, тому FSA (British Food Standard Agency) рекомендує переглянути пораду британського відділу охорони здоров’я від 2002 року, що, хоча, слід надавати перевагу грудному вигодовуванню, коли це є можливим, а у випадку відсутності такої можливості для немовлят, які не переносять коров’яче молоко або тих, батьки яких обрали веганську дієту, підходящим варіантом є соєві суміші. До недавнього часу соєві суміші були єдиною можливістю для немовлят, які не знаходяться на грудному вигодовуванні і мають алергію на коров’яче молоко або непереносимість лактози. Наразі доступні гідролізати коров’ячого молока для новонароджених з алергічною реакцією на коров’яче молоко. Найкращим варіантом визнано гідролізоване коров’яче молоко в порівнянні з соєвими сумішами, оскільки соя також може служити алергеном. Для немовлят з непереносимістю лактози та родин, які притримуються веганства єдиним вибором є соєві суміші (при відсутності грудного вигодовування).
У частини споживачів біодобавок з фітоестрогенами (дози понад 50 мг/день), веганів та населення Південно-Східної Азії вплив буде вищим за 0,4 мг/кг ізофлавонів мт/день. З іншого боку, рівень споживання, очевидно, буде нижчим за 2 мг/кг мт/день, що визнано безпечним клінічними дослідженнями. Сучасні знання не дають можливості дійти висновку, чи вплив на здоров’я (корисний або несприятливий) виникне у людей, які отримують 0,7 та 2 мг/кг мт/день. Є необхідність у проведенні великих тривалих досліджень для встановлення зв’язку між споживанням фітоестрогенів та розвитком деяких захворювань, особливо остеопорозу, раку молочних залоз, раку простати (FSA, 2003).
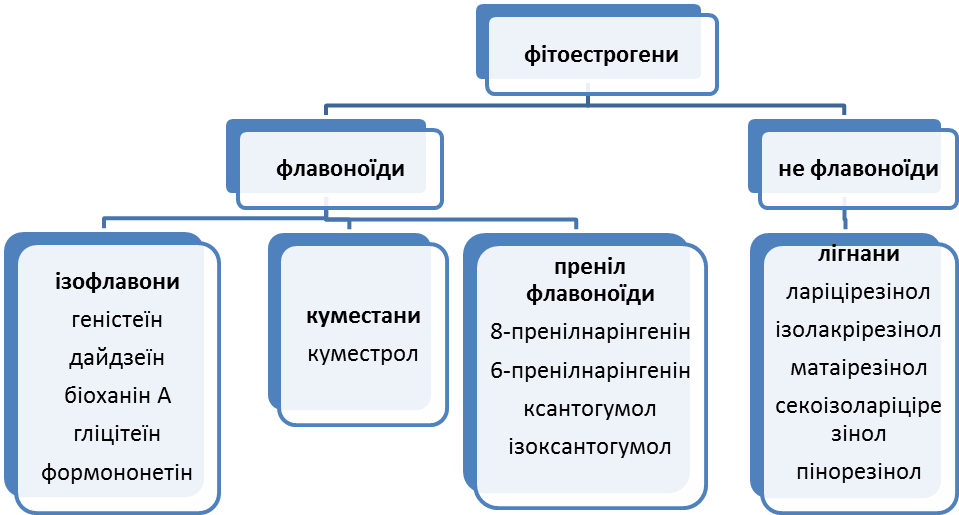
Групи естрогенів
(адаптовано Bakker з FSA, 2003; British Food Standard Agency).
Альтернативні назви / синоніми:
Ізофлавони, соя, біоханін А, дайдзеїн, дайдзин, геністеїн, еквол (S-equol), куместрол (coumestrol).
Еквол метаболізується з даідзеїну. Тільки 30-50% людей мають кишкові бактерії, які виробляють еквол; енантіомерна форма S (S–equol) переважно зв’язує рецептор естрогену бета.
Діюча речовина: фітоестрогени.
Рекомендації при вагітності:
Дотримуватись встановленої безпечної дози з харчуванням.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Виходячи з даних від експериментальних тварин та повідомлень про використання у людини не очікується підвищення ризику вроджених вад розвитку при споживанні ізофлавонів з їжею. Вплив геністеїну та сумішей на основі сої на репродукцію та розвиток широко висвітлені центром оцінки ризиків репродукції (Center for the Evaluation of Risks to Human Reproduction), який висловлює незначну стурбованість з приводу впливу на дорослих геністеїну з їжею. Експертна група центру дійшла висновку про мінімальне занепокоєння щодо несприятливих ефектів на розвиток дітей, яких годують соєвими дитячими сумішами.
Інформація щодо досліджень на тваринах:
Фітоестрогени продемонстрували естрогенну активність в експериментальних тварин та при дослідженнях in vitro. Репродуктивна здатність тварин, які споживають достатньо велику кількість фітоестрогенів, може порушуватись. При лікуванні мишей куместролом спостерігали дефіцит овуляції та раннього виживання ембріонів. При введенні матерям через зонд куместролу в дозі 0,1 та 1,0 мг/кг в період лактації у потомства жіночої статі відмічали зменшення ваги яєчників в ранньому дорослому віці. Вівці, які пасуть конюшину, стають перманентно субфертильними зі зниженням відповіді на естрогенну стимуляцію. Корови демонструють тимчасову неплідність при годуванні їх силосом з вмістом конюшини. При годуванні самців перепелів біоханіном А відмічали зниження копулятивної поведінки без зниження фертильності. Репродуктивні наслідки дієти, багатої ізофлавонами, також досліджувались у щурів та мавп.
Геністеїн, соєвий фітоестроген, не впливав на фертильність чи розвиток генітального тракту при годуванні щурів дозами до 250 мг/кг/день. Геністеїн транспортується до плодового відділу при досліджені in vitro з використанням плаценти людини і тільки невелика фракція конвертувалась плацентою до геністіну, кон’югованої форми, яка швидше екскретується. Дослідження у щурів не виявили тератогенності при впливі геністеїну в дозах до 1000 мг/кг/день. У щурів підтримували експериментальні ендометріотичні імпланти з геністеїном з ін’єкційними дозами до 16,6 мг/кг. Вплив на пізніх термінах вагітності та в період лактації в дозах приблизно 50 мкг/день у щурів (порівняльні до рекомендованої дози для людини без корекції на вагу) призводив до аномалій репродуктивних гормонів при відлученні дитинчат, рівні яких відновились до віку 70 днів життя. Стійкі кістозні зміни яєчників у новонароджених з впливом геністеїну залишались і в дорослому віці. Ін’єкції 20 мкг геністеїну мишам на 15-20 гестаційні дні призводили до гістологічних змін молочних залоз. Хоча формування пухлин молочних залоз у потомства не моніторувалось цим дослідженням, автори висловили стурбованість щодо спровокованого геністеїном ризику розвитку пухлин. Інший соєвий фітоестроген, дайдзеїн, не чинив несприятливого впливу на репродукцію та розвиток геніталій у потомства щурів після впливу з дієтою дози 250 або 1000 мг/кг. При іншому дослідженні у щурів введення з дієтою 300-800 мг/кг геністеїну протягом гестації істотно підвищувало кількість дитинчат жіночої статі. Оскільки розмір посліду був незначно підвищеним в цих тварин, таке явище не відображає токсичного впливу на потомство чоловічої статі. Повідомлення 2007 року інформує про пероральне введення через зонд вагітним мишам на 13-17 гестаційні дні геністеїном в дозі 0,17 мг/кг/день, потомство яких мало підвищену частоту гіпоспадії. При впливі геністеїну на мишей чоловічої статі на пізніх термінах вагітності та в ранньому періоді лактації вони демонстрували тривожну та агресивну поведінку. Пренатальний вплив на щурів геністеїну покращував просторові навчання і пам’ять та зменшував пасивне уникнення навчання/пам’яті.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Аналіз даних щодо харчування та способу життя, проспективно отриманих тривалим дослідженням (Avon Longitudinal Study of Pregnancy and Childhood), виявив статистично істотну асоціацію між вегетаріанською дієтою при вагітності та ризиком гіпоспадії у потомства. Дослідники припустили, що цю асоціацію можна пояснити вмістом фітоестрогенів. Додаткових даних щодо такої асоціації не знайдено. Аналіз результатів застосування допоміжних репродуктивних технологій продемонстрував невелику, але статистично значиму користь дієти з вмістом сої в когорті жінок, які повідомили про високий рівень споживання цього продукту.
Група коментаторів припустила, що високий вміст фітоестрогенів в дієті японців може пояснити відносно низьку частоту приливів та інших менопаузальних симптомів у японських жінок. Інші дослідники вивчали фітоестрогени у алкогольних напоях для визначення, чи це пояснює фемінізацію, яка виникає в частини чоловіків, які зловживають алкоголем.
В невеликої групи жінок в періоді пременопаузи, які споживали 60 грам соєвого протеїну на день (містить 45 мг ізофлавонів), спостерігали істотне порушення менструального циклу, ймовірно, за рахунок естрогенної активності фітоестрогенів з дієти. Ці зміни включали: подовження фолікулярної фази циклу (на 2,5 днів), зниження концентрації лютеїнізуючого та фолікулостимулюючого гормонів в середині циклу. Автори припустили, що вищі дози харчових ізофлавонів, такі як визначені у японських жінок (150-200 мг/день) можуть ще істотніше впливати на менструальний цикл.
Соєві суміші для новонароджених.
Фітоестрогени геністеїн та дайдзеїн можуть виявлятись в деяких сумішах для немовлят. Було висловлене занепокоєння стосовно того, що щоденне споживання немовлятами ізофлавонів з цими сумішами може бути в 6-11 разів вищим за дозу, яка призводить до гормонального ефекту у жінок в пременопаузі. Це дослідження не виявило, що суміші на основі коров’ячого молока або грудне молоко є істотними джерелами фітоестрогенів. Можливі ефекти високого рівня ізофлавоноїдних фітоестрогенів вивчали в японських новонароджених, а наступне дослідження проводилось в групі молодих дорослих, які в неонатальному віці приймали участь в контрольованому дослідженні, отримуючи соєву суміш або коров’яче молоко. Не виявлено істотної різниці після порівняння груп, виходячи з повідомлень щодо статевого дозрівання та репродуктивного здоров’я. Коментатори цих знахідок припустили, що частина показників, таких як імунна реакція, нерегулярність менструацій, вплив на плідність у чоловіків, потребують подальшого вивчення перед тим, як зробити висновок щодо безпечності соєвих сумішей для новонароджених. Коментатори у 1990 роках відмітили відсутність остаточних доказів шкоди або користі для немовлят від впливу ізофлавонів. Повідомлення 2015 року, яке припустило можливе підвищення ризику ендометріозу у жінок, що регулярно споживали соєві суміші в неонатальному віці, виходило з інформації про >10 жінок, про чиє споживання таких сумішей відомо з повідомлень матерів у 18% опитаних.
Застосування препарату під час вигодовування: відсутня інформація.
Вплив на фертильність (чоловіків та жінок):
У чоловіків.
Мета-аналіз досліджень у чоловіків, лікованих соєвим протеїном або ізофлавонами, не виявив впливу на рівень тестостерону або секс-зв’язуючого глобуліну. Чоловіки, які отримували соєвий білковий ізолят з вмістом ізофлавонів понад 60 мг/день протягом 57 днів, не демонстрували зменшення якості сперми.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Bakker MI. Dietary intake of phytoestrogens. RIVM report 320103002/2004. (https://www.rivm.nl/bibliotheek/rapporten/320103002.pdf).
Адаптовано 05.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 06.07.2018 р.
БЕРИЛІЙ
Група/призначення:
Хімічний елемент, метал. Берилій є двовалентним металом, який найчастіше використовується в промисловості як закріплююча речовина для сплавів.
Альтернативні назви / синоніми: немає.
Діюча речовина: берилій.
Рекомендації при вагітності:
Обмежена інформація, уникати промислового впливу високих концентрацій.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Вплив берилію на розвиток ембріону повноцінно не вивчено. Легені є первинним шляхом поглинання берилію. Окрім виробництва вплив берилію асоціюється з газоподібним стоком з горючих корисних копалин та випаровуванням речовин, які містять берилій з камінів газових ліхтарів.Токсична реакція цієї речовини включає захворювання легень, алергію та аутоімунні явища.
Інформація щодо досліджень на тваринах:
Дослідження, проведені в 1950 роках виявили, що сульфат берилію не є тератогенним для пташенят. Застосування солей берилію вагітним щурам підвищило частоту випадків смерті ембріону та набряку плода, але не асоціювалося із зростанням кількості випадків вроджених вад розвитку. Одне з цих досліджень застосувало інгаляційний шлях впливу, але це була оцінка вторинного джерела. Інше дослідження використовувало одноразові високі дози ін’єкції, але не було націлено на визначення можливого впливу на вагітність. Ці ж дослідники використали високі дози внутрішньовенних ін’єкцій нітрату берилію у щурів і виявили гістологічні аномалії жіночої репродуктивної системи.
Інформація щодо впливу на плід:
Описано один випадок щодо жінки, яка, як вважається, мала отруєння берилієм, протягом другої вагітності у віці 25 років. Вона отруїлася берилієм між 17 і 19 роками, коли працювала на фабриці по виготовленню люмінесцентних ламп. Її перша вагітність протікала без особливостей, і, хоча, у другої дитини не виявили несприятливих наслідків впливу берилію, його було виявлено в двох зразках сечі новонародженої. Не виявлено зростання ризику мертвонароджень чи малості для гестаційного віку серед новонароджених від чоловіків з впливом берилію
Застосування препарату під час вигодовування:
Берилій виявляється в грудному молоці. Дослідження щодо впливу на немовля невідомі.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 03.07.2018 р.:
Перекладач – К.В. Колядко.
Перевірено – Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
ЗЕРАНОЛ
Група/призначення:
Синтетичний анаболік з естрогеними властивостями. Це нестероїдний анаболік, отримуваний з естрогенного мікотоксину зеараленону. Мікотоксин зеараленон ще називають «рослинним гормоном», він має втричі меншу естрогенну активність, аніж синтетичний зеранол.
Естрогенність ідентифікують стандартними дослідженнями, в залежності від шляху впливу. Зеранол є слабшим естрогеном, ніж естрадіол (від 150 до 10000). Описано плацентарний трансфер.
В силу своїх анаболічних властивостей зеранол нелегально використовується для покращення росту комерційних овець та великої рогатої худоби м’ясних порід.
Альтернативні назви / синоніми:
Зеараланол, альфа-зеараланол, фрідерон, ралабол, ралгро, зерано, P1496.
Діюча речовина: зеранол.
Рекомендації при вагітності:
Отримана з харчуванням кількість не представляє ризику для плода.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Виходячи з експериментів у тварин кількість зеранолу, яку вагітна отримає із спожитим м’ясом, не чинить несприятливого впливу на розвиток ембріону.
Інформація щодо досліджень на тваринах:
Дослідження у гризунів не продемонстрували підвищення ризику вроджених вад, не пов’язаних із статевими органами, хоча спостерігали зменшення ваги плодів та підвищення ембріо-фетальної летальності після призначення зеранолу матерям. Пренатальний вплив цього агенту може змінювати структуру та функцію яєчок у мишей. Розведення самок свиней із використанням імплантів зеранолу спричиняло зменшення числа плодів, їхньої ваги та довжини, виживання.
Інформація щодо впливу на плід: відсутня інформація.
Застосування препарату під час вигодовування: відсутня інформація.
Вплив на фертильність (чоловіків та жінок):
Імплантування таблетки зеранолу (12 мг) на 30 днів самцям щурів викликало істотне зниження ваги простати та яєчок. Також спостерігали атрофію сім’явиносних канальців. Призначення зеранолу бикам призводило до зменшення розміру калитки та яєчок, що позначалось на репродуктивних функціях. Ці ефекти були зворотними, а лікування старших тварин не значно впливало на репродуктивні показники або взагалі цього не відбувалося.
У самців свиней не спостерігали несприятливих репродуктивних наслідків в результаті лікування зеранолом в дозі до 28 мг. Самки свиней з імплантами зеранолу не демонстрували покращення фертильності. Дослідження in vitro зі спермою свиней продемонструвало зниження рівня зв’язування із zona pellucida.
Введення самцям мишей зеранолу інтраперитонеально до 50 мг/кг/день виявило несприятливий вплив на показники сперми та зниження рівня настання вагітності після парування з самками без впливу зеранолу. Ці знахідки не можна застосувати для людини через не типовий шлях введення.
У корів зеранол в цілому не призводив до несприятливих наслідків на час пубертатну та не впливав на успішність вагітностей. Одне з цих досліджень дійшло висновку про зниження рівня настання вагітності у лікованих тварин, однак, представлені дані цього не підтверджують. Інше повідомлення інформує про несприятливий вплив на рівень вагітностей у корів з тривалим лікуванням зеранолом.
Відсутня інформація про можливий вплив на репродуктивну функцію у людини, однак, проводилось тестування із зеранолом (фрідерон або P1496) у людини як можливим препаратом для гормональної терапії в період менопаузи – виявлено, що 75 мг на день зменшували приливи в порівнянні з плацебо. Доза 100 мг/день викликала естрогенні зміни у клітинах піхви. В жодному випадку не повідомляється про несприятливі події.
Після повідомлення про певні «грудні симптоми» (печія, поколювання, біль) у працівників з впливом зеранолу було проведене невелике дослідження з охопленням 8 працівників. В крові не виявлявся ні зеранол, ані зеараленон, а концентрації фолікулостимулюючого гормону, лютеїнізуючого гормону та пролактину були нормальними. В одного працівника виявлено підвищений рівень естрадіолу. Повідомляється про гінекомастію у 5 хлопчиків з впливом забрудненого зеранолом одягу працівників.
Дослідження у тварин встановили максимальну дозу, що не призводить до несприятливих наслідків (no observed effects level (NOEL) – 0,5-0,1 мг/кг/день. Концентрація зеранолу у м’язах лікованої великої рогатої худоби менша або дорівнює 0,2 ppb (1 частина на мільярд; parts per billion). Така кількість призводить до впливу, принаймні, на три порядки нижчого, ніж визначена NOEL, що припускає незначний ризик від впливу зеранолу, який присутній у м’ясі, яке ми споживаємо.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
ЗЕАРАЛЕНОН
Група/призначення:
Нестероїдний мікотоксин. Виробляється пліснявими грибами роду Fusarium graminearum (також називається Gibberella zeae). Вражає кукурудзу, ячмінь, рис, овес, пшеницю, жито, тощо, також горіхи, банани, чорний перець. Це єдиний мікотоксин з первинними естрогенними ефектами. Споріднена споалука – альфа-зеараленон (зеранол), який в силу своїх анаболічних властивостей нелегально використовується для покращення росту комерційних овець та великої рогатої худоби м’ясних порід.
Альтернативні назви / синоніми: токсин F-2.
Діюча речовина: зеараленон.
Рекомендації при вагітності:
Відсутня інформація, слід уникати забруднениз сполукою продуктів харчування.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Зеараленон призводить до гіперестрогенних ефектів, включно зі зниженням фертильності в експериментальних тварин. У щурів, але не в мишей, відзначали порушення сексуального розвитку в потомства. Відсутня інформація щодо впливу на людину.
Інформація щодо досліджень на тваринах:
Гіперестрогенні порушення внаслідок споживання зеараленону найчастіше описували у свиней, включно з набряком зовнішніх статевих органів, збільшенням матки, аномаліями яєчників, дегенерацією ооцитів, порушенням еструсу, втратою ембріонів. Годування вагітних свиноматок продуктами з вмістом зеараленону в дозах 2,2 ppb (1 частина на мільярд; parts per billion) – на 2-4 порядки менше, ніж при позитивних результатах – не підвищувало частоти несприятливих результатів вагітностей. Зеараленон не змогли визначити в молоці. Додаткове дослідження виявило зменшення кількості здорових фолікулів у свиней препубертатного віку, які зазнали пре- та постнатального впливу з дієтою, забрудненою зеараленоном в дозах 200, 500 або 1000 мкг/кг.
Дослідження в інших ссавців підтвердили естрогенність зеараленону. У самок кролів сполука транзиторно порушувала склад трубної рідини, наступні вагітності були нормальними. У мишей радіоізотопний зеараленон виявляли в органах, таргетних для естрогену, включно з маткою, яєчками, фолікулами яєчників. У плодів препарат виявляли тільки на пізніх термінах вагітності в нирках, жовчному міхурі, сполучній тканині. В поросят зеараленон первинно виявляли в жовчному міхурі після годування свиноматок дієтою з вмістом 0,358 мг/кг на 75-110 гестаційні дні (всього 114).
Годування 4 поколінь мишей зеараленоном прискорювало початок пубертатну в перших 3 поколіннях, найвища використана доза становила 20 ppm (частин на мільйон, parts per million). У першому та другому поколіннях (F1, F2) спостерігали зменшення рівня імплантації та настання вагітностей, розміру потомства і збільшення розриву між вагітностями та тривалості гестації, в F2 також зниження фертильності. Самки F3 отримували 0 або 20 ppm зеараленону при відлученні потомства. Прискорений пубертат спостерігали в групі тварин з впливом після відлучення, а в групі з впливом до та після відлучення – зниження імплантації. Відсутність ефектів в групі без впливу після відлучення від матері припускає зворотність, принаймні, деяких несприятливих наслідків.
Норкам з молоком призначали разом із зеараленоном тамоксифен (антиестрогенний, антинеопластичний засіб) для з’ясування можливості пом’якшення естрогенних властивостей зеараленону. Однак, тамоксифен посилював естрогенний ефект. Тератологічні дослідження у мишей були негативними на фоні материнської дози до 20 мг/кг. Введення зеараленону вагітним щурам щодня через зонд в дозі 1-8 мг/кг/день на 6-19 гестаційні дні продемонструвало залежну від дози материнську та фетальну токсичність. Зменшення ваги плодів спостерігали на фоні всіх використаних доз. У вагітних щурів, яких годували продуктами з вмістом високих доз зеараленону, плоди мали затримку розвитку, асоційовану з материнською токсичністю. Інші дослідження у щурів продемонстрували порушення циклічності, затримку розвитку плодів, зниження фертильності у потомства з впливом зеараленону з дієтою при вагітності. Повідомляється про дослідження, яке порівнювало різні естрогенні сполуки і виявило, що введення підшкірно 10 мг/кг/день зеараленону вагітним мишам призвело до прискорення диференціації молочної залози у потомства та підвищення часу еструсу. В групі зеараленону на 4, 8, 12 та 16 тижнях життя відмічали відсутність жовтого тіла та вагінальної корніфікації. При порівнянні з геністеїном (фітоестрогени), діетилстильбестролом, резвератролом, біфенолом А зеараленон має триваліший вплив на репродуктивні органи та молочні залози.
Самки щурів Wistar (штам лабораторних щурів-альбіносів) з впливом зеараленону в дозі 0,2 мкг-5 мг/кг протягом останніх 14 днів вагітності та перших 5 постнатальних днів були обстежені щодо розвитку та зрілості тканин молочних залоз. На 180 постнатальний день тканини молочних залоз були більш диференційованими у всіх зеараленонових групах. У віці 6 місяців 4 з 18 самок з впливом дози 5 мг/кг продемонстрували гіперпластичне ураження залоз. Вплив перед паруванням дози зеараленону 40 ppm з дієтою знижував рівень плідності, в той час як вплив після парування цієї ж дози – затримував транспорт та доімплантаційний розвиток ембріонів, що згодом порушувало їхню імплантацію. Автори дійшли висновку, що вплив зеараленону з дієтою після відлучення від самки може сприяти передчасному пубертатну та порушувати ранні/початкові стадії вагітності.
У кобил низька доза зеараленону (7 мг/день) від 10 дня циклу до наступної овуляції не впливала на міжовуляторний інтервал, лютеїнову чи фолікулярну фази, прогестероновий профіль, фолікулярну активність, набряк матки.
У собак доза 200 мкг/кг протягом 7 днів призводила до атрезії фолікулярних клітин, набряку та гіперплазії клітин яйцепроводу та матки. Автори відзначили, що корм для тварин може містити 5,0-299,5 мкг/кг зеараленону. Інша стаття цих дослідників повідомила, що в собак, які отримували до 50 мкг/кг протягом 100 днів, наступала залежна від дози дегенерація гранульозних клітин.
Годування індиків їжею з Fusarium несприятливо впливало на продукцію яєць, але чистий зеараленон впливав не так драматично. Автори дійшли висновку, що інші сполуки, які забруднюють, їжу можуть відповідати за репродуктивну токсичність. Курчата є стійкими до токсичних репродуктивних наслідків зеараленону.
Поведінкове дослідження у щурів з оваріектомією виявило, що зеараленон в дозі 1 та 2 мг (але не 0,2 мг) підвищував концентрацію нейрональних прогестинових рецепторів. Доза 2 мг підвищувала щільність фарбування прогестеронових рецепторів в порівнянні з 10 мкг естрадіолу бензоату; 2 мг зеараленону еквівалентні естрадіолу в індукції сексуальної сприйнятливості після лікування прогестероном.
Інформація щодо впливу на плід:
Відсутні репродуктивні дослідження у людини.
Абстракт статті на китайській мові пов’язав споживання зерна, забрудненого Fusarium з «ендемічною хворобою збільшення грудних залоз» в Китаї.
Застосування препарату під час вигодовування:
Зеараленон виявляється в молоці корів разом з його кон’югатами та зеараленолом (естрогеновий метаболіт) після високої пероральної дози.
Відсутня інформація про вплив зеараленону при грудному вигодовуванні у людини.
Вплив на фертильність (чоловіків та жінок):
У чоловічої статі.
Невелику групу кабанів годували 0,2 або 1,0 ppm зеараленону без несприятливого впливу на лібідо або якість сперми. Інше дослідження не виявило негативного впливу на показники сперми при дозах до 200 ppm з дієтою. У самців щурів доза 0,25 мг/кг, введена шляхом гастральної інтубації, знижувала споживання їжі та вагу тіла, концентрацію тестостерону в сироватці, кількість сперматозоїдів в хвості придатку яєчка та вагу репродуктивних органів. Інше дослідження виявило, що висока доза зеараленону протягом 5 тижнів істотно підвищувала концентрацію пролактину в сироватці, інших змін не виявляли. Введення самцям мишей інтраперитонеально 25 мг/кг/день протягом 7 днів негативно впливало на сперматозоїди, а після парування з нелікованими самками підвищувався рівень резорбції. Введення мишам через зонд дози 40 мг/кг (8% LD50; середня летальна доза, median lethal dose, “lethal dose, 50%”) призводило до істотного зниження тестостерону. Самців фазанів годували забрудненою мікотоксином їжею, в результаті чого розвинулась атрофія яєчок з особливим впливом на гермінальний епітелій, яйця у самок після парування були неплідними.
Введення самцям щурів зеараленону з питною водою в дозі 0,15 мкг/л зменшувало концентрацію сперми, підвищувало кількість морфологічно аномальних сперматозоїдів та підвищувало зв’язування апоптичного маркеру аннексину V. Також спостерігали зміни генів, відповідальних за сперматогенез. Автори наголошують на сильнішому ефекті цієї дози в порівнянні з вищою дозою 150 мкг/л (з питною водою).
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
ЕДРОФОНІЙ
Група/призначення:
Парасимпатоміметик, холінергічний засіб.
Альтернативні назви / синоніми: тенсілон, енлон.
Діюча речовина: едрофоній.
Рекомендації при вагітності:
Припускається ризик в ІІІ триместрі.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Це четвертинна сполука амонію з антихолінестеразною активністю, яку використовують для діагностики міастенія гравіс* без підвищення частоти вроджених вад розвитку.
|
*Міастенія гравіс (myasthenia gravis) – аутоімунне захворювання, яке викликає прогресуючу слабкість м’язів в результаті порушення нервово-м’язової передачі. У більшості випадків страждають м’язи очей, жувальні і лицьові, рідше – дихальні. Частіше хворіють жінки у віці. |
Інформація щодо досліджень на тваринах:
Відсутня. Препарати цього класу пов’язують з порушеннями опорно-рухового апарату ембріонів курчат. Це пояснюється важливою роллю ацетилхоліну в ембріональному розвитку.
Інформація щодо впливу на плід:
Досвід застосування обмежений.
Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до ембріону/плода.
Деякі автори висловлюють стурбованість щодо внутрішньовенного введення антихолінестераз через можливість індукції передчасних пологів.
Цей вплив на вагітну матку зростає перед пологами. Рекомендується введення неостигміну внутрішньом’язово як альтернатива внутрішньовенному едрофонію, якщо цього вимагає захворювання вагітної. Однак, потенційними ускладненнями внутрішньому’язово введеного неостигміну є вагінальні кровотечі та аборти. Повідомляється про внутрішньовенне введення едрофонію жінці в ІІ триместрі в невдалій спробі лікування тахікардії, вторинної до синдрому Вольфа-Паркінсона-Уайта. Не спостерігали впливу на матку, вагітність була доношена.
Транзиторна м’язова слабкість спостерігається у 20% новонароджених від матерів з міастенія гравіс. Неонатальну міастенію викликає трансплацентарний пасаж антитіл IgG до ацетилхолінових рецепторів.
Застосування препарату під час вигодовування:
Відсутня інформація. Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до грудного молока. Вплив такої кількості препарату на немовля невідомий, якщо взагалі існує.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
АМБЕНОНІЙ
Група/призначення:
Парасимпатоміметик, холінергічний засіб.
Альтернативні назви / синоніми:
Оксазил, амбенонію хлорид.
Діюча речовина: амбеноній.
Рекомендації при вагітності:
Обмежені дані; відсутні дані від експериментальних тварин.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Досвід застосування у людини при вагітності дуже обмежений і недостатній для оцінки ембріо-фетального ризику. Відсутні дані від експериментальних тварин.
Це четвертинна сполука амонію, яку використовують для діагностики та лікування міастенія гравіс*.
|
*Міастенія гравіс (myasthenia gravis) – аутоімунне захворювання, яке викликає прогресуючу слабкість м’язів в результаті порушення нервово-м’язової передачі. У більшості випадків страждають м’язи очей, жувальні і лицьові, рідше – дихальні. Частіше хворіють жінки у віці. |
Інформація щодо досліджень на тваринах:
Відсутня. Препарати цього класу пов’язують з порушеннями опорно-рухового апарату ембріонів курчат. Це пояснюється важливою роллю ацетилхоліну в ембріональному розвитку.
Інформація щодо впливу на плід:
Досвід застосування обмежений.
Повідомляється про випадок прийому жінкою амбенонію (60 мг/день), піридостигміну (420 мг/день), неостигміну (105 мг/день) протягом вагітності без шкоди для плода.
Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до ембріону/плода.
Деякі автори висловлюють стурбованість щодо внутрішньовенного введення антихолінестераз через можливість індукції передчасних пологів.
Транзиторна м’язова слабкість спостерігається у 20% новонароджених від матерів з міастенія гравіс. Неонатальну міастенію викликає трансплацентарний пасаж антитіл IgG до ацетилхолінових рецепторів.
Застосування препарату під час вигодовування:
Відсутня інформація. Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до грудного молока. Проте кількість препарату в грудному молоці є, очевидно, малою. Вплив такої кількості на немовля невідомий, якщо взагалі існує.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
СУГАМАДЕКС
Група/призначення:
Антидот, селективний антагоніст рокуронію та векуронію.
Покази: реверсія нейром’язової блокади, спричиненої рокуронієм або верокуронієм.
Альтернативні назви / синоніми: брайдан.
Діюча речовина: сугамадекс.
Рекомендації при вагітності:
Відсутні дані; дані від експериментальних тварин припускають низький ризик.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Не призводить до вроджених вад розвитку у щурів та кролів.
Інформація щодо досліджень на тваринах:
Згідно з інструкцією до препарату не спостерігали підвищення частоти вроджених вад розвитку після внутрішньовенного введення щурам та кролям на 6-17 дні вагітності в дозах, які у 6-8 раз перевищують максимальну рекомендовану для людини, виходячи з AUC*.
|
*AUC – фармакокінетичний параметр, який характеризує сумарну концентрацію лікарського препарату в плазмі крові протягом всього часу спостереження; це абревіатура від англ. Area Under the Curve (площа під кривою). |
У кролів спостерігали зменшення ваги плодів та затримку осифікації на фоні материнської токсичності при 8-кратній від максимальної рекомендованої для людини дозі. Зниження ваги плодів кролів відзначали і на фоні подвійної максимальної рекомендованої дози для людини, при якій не відзначали токсичного впливу на матір.
Повідомлення 2015 року інформує про введення сугамадексу вагітним щурам в дозі 30 мг/кг внутрішньовенно з або без 3,5 мг/кг рокуронію на 7 гестаційний день. Це не впливало на концентрацію прогестерону. Вагітності протікали нормально, без самовільного переривання та мертвонароджень. Потомство макроскопічно виглядало нормальним.
Інформація щодо впливу на плід:
Відсутній досвід застосування.
У 2016 році повідомили про успішне використання сугамадексу в якості зворотнього агенту для неостигміну у вагітної з синдромом Вольфа-Паркінсона-Уайта (це синдром передчасного збудження шлуночків по додатковому (аномальному) шляху проведення імпульсів, а також виникненням надшлуночкових тахіаритмій по типу re-entry).
Застосування препарату під час вигодовування:
Згідно з інструкцією до препарату він проникає до молока щурів. Вплив на щуренят з молоком не призводив до несприятливого впливу на вагу, фізичний розвиток та поведінку.
Вплив на фертильність (чоловіків та жінок):
Згідно з інструкцією сугамадекс знижує ефективність оральних контрацептивів шляхом пониження концентрації гормонів в сироватці. При введенні самцям щурів внутрішньовенно 6-кратних максимальній рекомендованій для людини доз протягом 29 днів перед та протягом парування, а самкам – протягом 14 днів до парування та ще 5 днів після не спостерігали несприятливих наслідків.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).