Editor
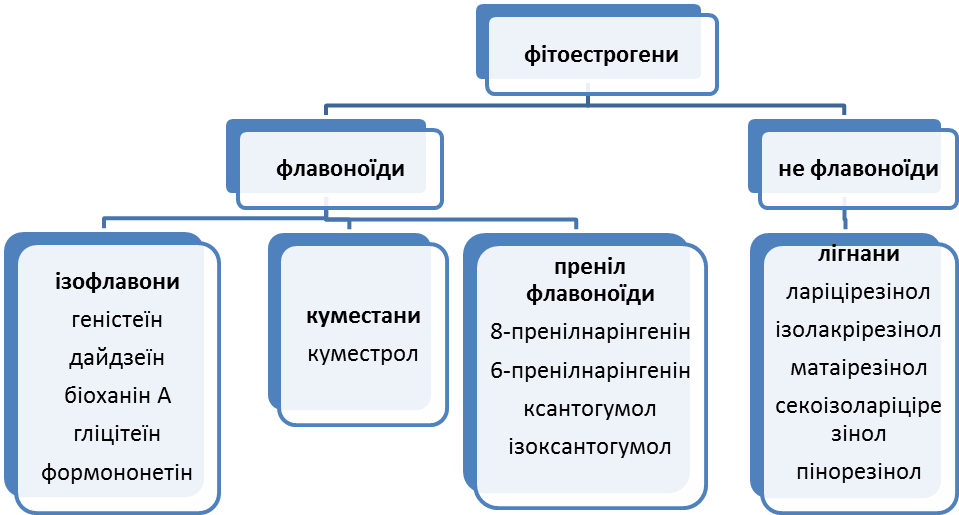
ФІТОЕСТРОГЕНИ
Група/призначення:
Це різнорідна група природних нестероїдних рослинних сполук, які завдяки своїй структурі, подібної до естрадіолу, можуть викликати естрогенний та (або) антиестрогенний ефект. Містяться в тваринних кормах, особливо конюшині та сої. Людина отримує фітоестрогени від споживання рослинних продуктів або з тваринними продуктами з попереднім впливом фітоестрогенів.
Найвищий рівень споживання ізофлавонів в раціоні звичайно є у споживачів, які приймають дієтичні добавки, що містять фітоестрогени (±40-100 мг/день), неонатальні суміші на основі сої (±40 мг/день), у веганів (±75 мг/день) та споживачів традиційної південно-східної азійської дієти (±25-100 мг/день). Середній рівень споживання ізофлавонів у європейців та вегетаріанців значно нижчий (±1–2 мг/день та ± 3-12 мг/день, відповідно).
Barnes (2003) критично проаналізував доступні дослідження щодо впливу фітоестрогенів і дійшов висновку, що пероральну дозу ізофлавону 50 мг/день (±0,7 мг/кг мт/день (маси тіла на день) слід вважати безпечною для більшості популяцій. Також допустимим є підвищення ліміту безпечності до 2 мг/кг мт/день в клінічних дослідженнях при ретельному моніторингу учасників.
При розрахунках на основі ваги новонароджених соєві суміші для немовлят містять найбільше ізофлавонів (±4-8 мг/кг мт/день). Це вище за попередньо зазначену безпечну дозу (Barnes). Доказів несприятливого впливу соєвих сумішей на функцію щитоподібної залози немовлят недостатньо. Проте стурбованість щодо потенційного ризику існує, тому FSA (British Food Standard Agency) рекомендує переглянути пораду британського відділу охорони здоров’я від 2002 року, що, хоча, слід надавати перевагу грудному вигодовуванню, коли це є можливим, а у випадку відсутності такої можливості для немовлят, які не переносять коров’яче молоко або тих, батьки яких обрали веганську дієту, підходящим варіантом є соєві суміші. До недавнього часу соєві суміші були єдиною можливістю для немовлят, які не знаходяться на грудному вигодовуванні і мають алергію на коров’яче молоко або непереносимість лактози. Наразі доступні гідролізати коров’ячого молока для новонароджених з алергічною реакцією на коров’яче молоко. Найкращим варіантом визнано гідролізоване коров’яче молоко в порівнянні з соєвими сумішами, оскільки соя також може служити алергеном. Для немовлят з непереносимістю лактози та родин, які притримуються веганства єдиним вибором є соєві суміші (при відсутності грудного вигодовування).
У частини споживачів біодобавок з фітоестрогенами (дози понад 50 мг/день), веганів та населення Південно-Східної Азії вплив буде вищим за 0,4 мг/кг ізофлавонів мт/день. З іншого боку, рівень споживання, очевидно, буде нижчим за 2 мг/кг мт/день, що визнано безпечним клінічними дослідженнями. Сучасні знання не дають можливості дійти висновку, чи вплив на здоров’я (корисний або несприятливий) виникне у людей, які отримують 0,7 та 2 мг/кг мт/день. Є необхідність у проведенні великих тривалих досліджень для встановлення зв’язку між споживанням фітоестрогенів та розвитком деяких захворювань, особливо остеопорозу, раку молочних залоз, раку простати (FSA, 2003).
Групи естрогенів
(адаптовано Bakker з FSA, 2003; British Food Standard Agency).
Альтернативні назви / синоніми:
Ізофлавони, соя, біоханін А, дайдзеїн, дайдзин, геністеїн, еквол (S-equol), куместрол (coumestrol).
Еквол метаболізується з даідзеїну. Тільки 30-50% людей мають кишкові бактерії, які виробляють еквол; енантіомерна форма S (S–equol) переважно зв’язує рецептор естрогену бета.
Діюча речовина: фітоестрогени.
Рекомендації при вагітності:
Дотримуватись встановленої безпечної дози з харчуванням.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Виходячи з даних від експериментальних тварин та повідомлень про використання у людини не очікується підвищення ризику вроджених вад розвитку при споживанні ізофлавонів з їжею. Вплив геністеїну та сумішей на основі сої на репродукцію та розвиток широко висвітлені центром оцінки ризиків репродукції (Center for the Evaluation of Risks to Human Reproduction), який висловлює незначну стурбованість з приводу впливу на дорослих геністеїну з їжею. Експертна група центру дійшла висновку про мінімальне занепокоєння щодо несприятливих ефектів на розвиток дітей, яких годують соєвими дитячими сумішами.
Інформація щодо досліджень на тваринах:
Фітоестрогени продемонстрували естрогенну активність в експериментальних тварин та при дослідженнях in vitro. Репродуктивна здатність тварин, які споживають достатньо велику кількість фітоестрогенів, може порушуватись. При лікуванні мишей куместролом спостерігали дефіцит овуляції та раннього виживання ембріонів. При введенні матерям через зонд куместролу в дозі 0,1 та 1,0 мг/кг в період лактації у потомства жіночої статі відмічали зменшення ваги яєчників в ранньому дорослому віці. Вівці, які пасуть конюшину, стають перманентно субфертильними зі зниженням відповіді на естрогенну стимуляцію. Корови демонструють тимчасову неплідність при годуванні їх силосом з вмістом конюшини. При годуванні самців перепелів біоханіном А відмічали зниження копулятивної поведінки без зниження фертильності. Репродуктивні наслідки дієти, багатої ізофлавонами, також досліджувались у щурів та мавп.
Геністеїн, соєвий фітоестроген, не впливав на фертильність чи розвиток генітального тракту при годуванні щурів дозами до 250 мг/кг/день. Геністеїн транспортується до плодового відділу при досліджені in vitro з використанням плаценти людини і тільки невелика фракція конвертувалась плацентою до геністіну, кон’югованої форми, яка швидше екскретується. Дослідження у щурів не виявили тератогенності при впливі геністеїну в дозах до 1000 мг/кг/день. У щурів підтримували експериментальні ендометріотичні імпланти з геністеїном з ін’єкційними дозами до 16,6 мг/кг. Вплив на пізніх термінах вагітності та в період лактації в дозах приблизно 50 мкг/день у щурів (порівняльні до рекомендованої дози для людини без корекції на вагу) призводив до аномалій репродуктивних гормонів при відлученні дитинчат, рівні яких відновились до віку 70 днів життя. Стійкі кістозні зміни яєчників у новонароджених з впливом геністеїну залишались і в дорослому віці. Ін’єкції 20 мкг геністеїну мишам на 15-20 гестаційні дні призводили до гістологічних змін молочних залоз. Хоча формування пухлин молочних залоз у потомства не моніторувалось цим дослідженням, автори висловили стурбованість щодо спровокованого геністеїном ризику розвитку пухлин. Інший соєвий фітоестроген, дайдзеїн, не чинив несприятливого впливу на репродукцію та розвиток геніталій у потомства щурів після впливу з дієтою дози 250 або 1000 мг/кг. При іншому дослідженні у щурів введення з дієтою 300-800 мг/кг геністеїну протягом гестації істотно підвищувало кількість дитинчат жіночої статі. Оскільки розмір посліду був незначно підвищеним в цих тварин, таке явище не відображає токсичного впливу на потомство чоловічої статі. Повідомлення 2007 року інформує про пероральне введення через зонд вагітним мишам на 13-17 гестаційні дні геністеїном в дозі 0,17 мг/кг/день, потомство яких мало підвищену частоту гіпоспадії. При впливі геністеїну на мишей чоловічої статі на пізніх термінах вагітності та в ранньому періоді лактації вони демонстрували тривожну та агресивну поведінку. Пренатальний вплив на щурів геністеїну покращував просторові навчання і пам’ять та зменшував пасивне уникнення навчання/пам’яті.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Аналіз даних щодо харчування та способу життя, проспективно отриманих тривалим дослідженням (Avon Longitudinal Study of Pregnancy and Childhood), виявив статистично істотну асоціацію між вегетаріанською дієтою при вагітності та ризиком гіпоспадії у потомства. Дослідники припустили, що цю асоціацію можна пояснити вмістом фітоестрогенів. Додаткових даних щодо такої асоціації не знайдено. Аналіз результатів застосування допоміжних репродуктивних технологій продемонстрував невелику, але статистично значиму користь дієти з вмістом сої в когорті жінок, які повідомили про високий рівень споживання цього продукту.
Група коментаторів припустила, що високий вміст фітоестрогенів в дієті японців може пояснити відносно низьку частоту приливів та інших менопаузальних симптомів у японських жінок. Інші дослідники вивчали фітоестрогени у алкогольних напоях для визначення, чи це пояснює фемінізацію, яка виникає в частини чоловіків, які зловживають алкоголем.
В невеликої групи жінок в періоді пременопаузи, які споживали 60 грам соєвого протеїну на день (містить 45 мг ізофлавонів), спостерігали істотне порушення менструального циклу, ймовірно, за рахунок естрогенної активності фітоестрогенів з дієти. Ці зміни включали: подовження фолікулярної фази циклу (на 2,5 днів), зниження концентрації лютеїнізуючого та фолікулостимулюючого гормонів в середині циклу. Автори припустили, що вищі дози харчових ізофлавонів, такі як визначені у японських жінок (150-200 мг/день) можуть ще істотніше впливати на менструальний цикл.
Соєві суміші для новонароджених.
Фітоестрогени геністеїн та дайдзеїн можуть виявлятись в деяких сумішах для немовлят. Було висловлене занепокоєння стосовно того, що щоденне споживання немовлятами ізофлавонів з цими сумішами може бути в 6-11 разів вищим за дозу, яка призводить до гормонального ефекту у жінок в пременопаузі. Це дослідження не виявило, що суміші на основі коров’ячого молока або грудне молоко є істотними джерелами фітоестрогенів. Можливі ефекти високого рівня ізофлавоноїдних фітоестрогенів вивчали в японських новонароджених, а наступне дослідження проводилось в групі молодих дорослих, які в неонатальному віці приймали участь в контрольованому дослідженні, отримуючи соєву суміш або коров’яче молоко. Не виявлено істотної різниці після порівняння груп, виходячи з повідомлень щодо статевого дозрівання та репродуктивного здоров’я. Коментатори цих знахідок припустили, що частина показників, таких як імунна реакція, нерегулярність менструацій, вплив на плідність у чоловіків, потребують подальшого вивчення перед тим, як зробити висновок щодо безпечності соєвих сумішей для новонароджених. Коментатори у 1990 роках відмітили відсутність остаточних доказів шкоди або користі для немовлят від впливу ізофлавонів. Повідомлення 2015 року, яке припустило можливе підвищення ризику ендометріозу у жінок, що регулярно споживали соєві суміші в неонатальному віці, виходило з інформації про >10 жінок, про чиє споживання таких сумішей відомо з повідомлень матерів у 18% опитаних.
Застосування препарату під час вигодовування: відсутня інформація.
Вплив на фертильність (чоловіків та жінок):
У чоловіків.
Мета-аналіз досліджень у чоловіків, лікованих соєвим протеїном або ізофлавонами, не виявив впливу на рівень тестостерону або секс-зв’язуючого глобуліну. Чоловіки, які отримували соєвий білковий ізолят з вмістом ізофлавонів понад 60 мг/день протягом 57 днів, не демонстрували зменшення якості сперми.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Bakker MI. Dietary intake of phytoestrogens. RIVM report 320103002/2004. (https://www.rivm.nl/bibliotheek/rapporten/320103002.pdf).
Адаптовано 05.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 06.07.2018 р.
БЕРИЛІЙ
Група/призначення:
Хімічний елемент, метал. Берилій є двовалентним металом, який найчастіше використовується в промисловості як закріплююча речовина для сплавів.
Альтернативні назви / синоніми: немає.
Діюча речовина: берилій.
Рекомендації при вагітності:
Обмежена інформація, уникати промислового впливу високих концентрацій.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Вплив берилію на розвиток ембріону повноцінно не вивчено. Легені є первинним шляхом поглинання берилію. Окрім виробництва вплив берилію асоціюється з газоподібним стоком з горючих корисних копалин та випаровуванням речовин, які містять берилій з камінів газових ліхтарів.Токсична реакція цієї речовини включає захворювання легень, алергію та аутоімунні явища.
Інформація щодо досліджень на тваринах:
Дослідження, проведені в 1950 роках виявили, що сульфат берилію не є тератогенним для пташенят. Застосування солей берилію вагітним щурам підвищило частоту випадків смерті ембріону та набряку плода, але не асоціювалося із зростанням кількості випадків вроджених вад розвитку. Одне з цих досліджень застосувало інгаляційний шлях впливу, але це була оцінка вторинного джерела. Інше дослідження використовувало одноразові високі дози ін’єкції, але не було націлено на визначення можливого впливу на вагітність. Ці ж дослідники використали високі дози внутрішньовенних ін’єкцій нітрату берилію у щурів і виявили гістологічні аномалії жіночої репродуктивної системи.
Інформація щодо впливу на плід:
Описано один випадок щодо жінки, яка, як вважається, мала отруєння берилієм, протягом другої вагітності у віці 25 років. Вона отруїлася берилієм між 17 і 19 роками, коли працювала на фабриці по виготовленню люмінесцентних ламп. Її перша вагітність протікала без особливостей, і, хоча, у другої дитини не виявили несприятливих наслідків впливу берилію, його було виявлено в двох зразках сечі новонародженої. Не виявлено зростання ризику мертвонароджень чи малості для гестаційного віку серед новонароджених від чоловіків з впливом берилію
Застосування препарату під час вигодовування:
Берилій виявляється в грудному молоці. Дослідження щодо впливу на немовля невідомі.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 03.07.2018 р.:
Перекладач – К.В. Колядко.
Перевірено – Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
ЗЕРАНОЛ
Група/призначення:
Синтетичний анаболік з естрогеними властивостями. Це нестероїдний анаболік, отримуваний з естрогенного мікотоксину зеараленону. Мікотоксин зеараленон ще називають «рослинним гормоном», він має втричі меншу естрогенну активність, аніж синтетичний зеранол.
Естрогенність ідентифікують стандартними дослідженнями, в залежності від шляху впливу. Зеранол є слабшим естрогеном, ніж естрадіол (від 150 до 10000). Описано плацентарний трансфер.
В силу своїх анаболічних властивостей зеранол нелегально використовується для покращення росту комерційних овець та великої рогатої худоби м’ясних порід.
Альтернативні назви / синоніми:
Зеараланол, альфа-зеараланол, фрідерон, ралабол, ралгро, зерано, P1496.
Діюча речовина: зеранол.
Рекомендації при вагітності:
Отримана з харчуванням кількість не представляє ризику для плода.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Виходячи з експериментів у тварин кількість зеранолу, яку вагітна отримає із спожитим м’ясом, не чинить несприятливого впливу на розвиток ембріону.
Інформація щодо досліджень на тваринах:
Дослідження у гризунів не продемонстрували підвищення ризику вроджених вад, не пов’язаних із статевими органами, хоча спостерігали зменшення ваги плодів та підвищення ембріо-фетальної летальності після призначення зеранолу матерям. Пренатальний вплив цього агенту може змінювати структуру та функцію яєчок у мишей. Розведення самок свиней із використанням імплантів зеранолу спричиняло зменшення числа плодів, їхньої ваги та довжини, виживання.
Інформація щодо впливу на плід: відсутня інформація.
Застосування препарату під час вигодовування: відсутня інформація.
Вплив на фертильність (чоловіків та жінок):
Імплантування таблетки зеранолу (12 мг) на 30 днів самцям щурів викликало істотне зниження ваги простати та яєчок. Також спостерігали атрофію сім’явиносних канальців. Призначення зеранолу бикам призводило до зменшення розміру калитки та яєчок, що позначалось на репродуктивних функціях. Ці ефекти були зворотними, а лікування старших тварин не значно впливало на репродуктивні показники або взагалі цього не відбувалося.
У самців свиней не спостерігали несприятливих репродуктивних наслідків в результаті лікування зеранолом в дозі до 28 мг. Самки свиней з імплантами зеранолу не демонстрували покращення фертильності. Дослідження in vitro зі спермою свиней продемонструвало зниження рівня зв’язування із zona pellucida.
Введення самцям мишей зеранолу інтраперитонеально до 50 мг/кг/день виявило несприятливий вплив на показники сперми та зниження рівня настання вагітності після парування з самками без впливу зеранолу. Ці знахідки не можна застосувати для людини через не типовий шлях введення.
У корів зеранол в цілому не призводив до несприятливих наслідків на час пубертатну та не впливав на успішність вагітностей. Одне з цих досліджень дійшло висновку про зниження рівня настання вагітності у лікованих тварин, однак, представлені дані цього не підтверджують. Інше повідомлення інформує про несприятливий вплив на рівень вагітностей у корів з тривалим лікуванням зеранолом.
Відсутня інформація про можливий вплив на репродуктивну функцію у людини, однак, проводилось тестування із зеранолом (фрідерон або P1496) у людини як можливим препаратом для гормональної терапії в період менопаузи – виявлено, що 75 мг на день зменшували приливи в порівнянні з плацебо. Доза 100 мг/день викликала естрогенні зміни у клітинах піхви. В жодному випадку не повідомляється про несприятливі події.
Після повідомлення про певні «грудні симптоми» (печія, поколювання, біль) у працівників з впливом зеранолу було проведене невелике дослідження з охопленням 8 працівників. В крові не виявлявся ні зеранол, ані зеараленон, а концентрації фолікулостимулюючого гормону, лютеїнізуючого гормону та пролактину були нормальними. В одного працівника виявлено підвищений рівень естрадіолу. Повідомляється про гінекомастію у 5 хлопчиків з впливом забрудненого зеранолом одягу працівників.
Дослідження у тварин встановили максимальну дозу, що не призводить до несприятливих наслідків (no observed effects level (NOEL) – 0,5-0,1 мг/кг/день. Концентрація зеранолу у м’язах лікованої великої рогатої худоби менша або дорівнює 0,2 ppb (1 частина на мільярд; parts per billion). Така кількість призводить до впливу, принаймні, на три порядки нижчого, ніж визначена NOEL, що припускає незначний ризик від впливу зеранолу, який присутній у м’ясі, яке ми споживаємо.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
ЗЕАРАЛЕНОН
Група/призначення:
Нестероїдний мікотоксин. Виробляється пліснявими грибами роду Fusarium graminearum (також називається Gibberella zeae). Вражає кукурудзу, ячмінь, рис, овес, пшеницю, жито, тощо, також горіхи, банани, чорний перець. Це єдиний мікотоксин з первинними естрогенними ефектами. Споріднена споалука – альфа-зеараленон (зеранол), який в силу своїх анаболічних властивостей нелегально використовується для покращення росту комерційних овець та великої рогатої худоби м’ясних порід.
Альтернативні назви / синоніми: токсин F-2.
Діюча речовина: зеараленон.
Рекомендації при вагітності:
Відсутня інформація, слід уникати забруднениз сполукою продуктів харчування.
Рекомендації при лактації: відсутня інформація.
Прийом під час вагітності (короткий висновок):
Зеараленон призводить до гіперестрогенних ефектів, включно зі зниженням фертильності в експериментальних тварин. У щурів, але не в мишей, відзначали порушення сексуального розвитку в потомства. Відсутня інформація щодо впливу на людину.
Інформація щодо досліджень на тваринах:
Гіперестрогенні порушення внаслідок споживання зеараленону найчастіше описували у свиней, включно з набряком зовнішніх статевих органів, збільшенням матки, аномаліями яєчників, дегенерацією ооцитів, порушенням еструсу, втратою ембріонів. Годування вагітних свиноматок продуктами з вмістом зеараленону в дозах 2,2 ppb (1 частина на мільярд; parts per billion) – на 2-4 порядки менше, ніж при позитивних результатах – не підвищувало частоти несприятливих результатів вагітностей. Зеараленон не змогли визначити в молоці. Додаткове дослідження виявило зменшення кількості здорових фолікулів у свиней препубертатного віку, які зазнали пре- та постнатального впливу з дієтою, забрудненою зеараленоном в дозах 200, 500 або 1000 мкг/кг.
Дослідження в інших ссавців підтвердили естрогенність зеараленону. У самок кролів сполука транзиторно порушувала склад трубної рідини, наступні вагітності були нормальними. У мишей радіоізотопний зеараленон виявляли в органах, таргетних для естрогену, включно з маткою, яєчками, фолікулами яєчників. У плодів препарат виявляли тільки на пізніх термінах вагітності в нирках, жовчному міхурі, сполучній тканині. В поросят зеараленон первинно виявляли в жовчному міхурі після годування свиноматок дієтою з вмістом 0,358 мг/кг на 75-110 гестаційні дні (всього 114).
Годування 4 поколінь мишей зеараленоном прискорювало початок пубертатну в перших 3 поколіннях, найвища використана доза становила 20 ppm (частин на мільйон, parts per million). У першому та другому поколіннях (F1, F2) спостерігали зменшення рівня імплантації та настання вагітностей, розміру потомства і збільшення розриву між вагітностями та тривалості гестації, в F2 також зниження фертильності. Самки F3 отримували 0 або 20 ppm зеараленону при відлученні потомства. Прискорений пубертат спостерігали в групі тварин з впливом після відлучення, а в групі з впливом до та після відлучення – зниження імплантації. Відсутність ефектів в групі без впливу після відлучення від матері припускає зворотність, принаймні, деяких несприятливих наслідків.
Норкам з молоком призначали разом із зеараленоном тамоксифен (антиестрогенний, антинеопластичний засіб) для з’ясування можливості пом’якшення естрогенних властивостей зеараленону. Однак, тамоксифен посилював естрогенний ефект. Тератологічні дослідження у мишей були негативними на фоні материнської дози до 20 мг/кг. Введення зеараленону вагітним щурам щодня через зонд в дозі 1-8 мг/кг/день на 6-19 гестаційні дні продемонструвало залежну від дози материнську та фетальну токсичність. Зменшення ваги плодів спостерігали на фоні всіх використаних доз. У вагітних щурів, яких годували продуктами з вмістом високих доз зеараленону, плоди мали затримку розвитку, асоційовану з материнською токсичністю. Інші дослідження у щурів продемонстрували порушення циклічності, затримку розвитку плодів, зниження фертильності у потомства з впливом зеараленону з дієтою при вагітності. Повідомляється про дослідження, яке порівнювало різні естрогенні сполуки і виявило, що введення підшкірно 10 мг/кг/день зеараленону вагітним мишам призвело до прискорення диференціації молочної залози у потомства та підвищення часу еструсу. В групі зеараленону на 4, 8, 12 та 16 тижнях життя відмічали відсутність жовтого тіла та вагінальної корніфікації. При порівнянні з геністеїном (фітоестрогени), діетилстильбестролом, резвератролом, біфенолом А зеараленон має триваліший вплив на репродуктивні органи та молочні залози.
Самки щурів Wistar (штам лабораторних щурів-альбіносів) з впливом зеараленону в дозі 0,2 мкг-5 мг/кг протягом останніх 14 днів вагітності та перших 5 постнатальних днів були обстежені щодо розвитку та зрілості тканин молочних залоз. На 180 постнатальний день тканини молочних залоз були більш диференційованими у всіх зеараленонових групах. У віці 6 місяців 4 з 18 самок з впливом дози 5 мг/кг продемонстрували гіперпластичне ураження залоз. Вплив перед паруванням дози зеараленону 40 ppm з дієтою знижував рівень плідності, в той час як вплив після парування цієї ж дози – затримував транспорт та доімплантаційний розвиток ембріонів, що згодом порушувало їхню імплантацію. Автори дійшли висновку, що вплив зеараленону з дієтою після відлучення від самки може сприяти передчасному пубертатну та порушувати ранні/початкові стадії вагітності.
У кобил низька доза зеараленону (7 мг/день) від 10 дня циклу до наступної овуляції не впливала на міжовуляторний інтервал, лютеїнову чи фолікулярну фази, прогестероновий профіль, фолікулярну активність, набряк матки.
У собак доза 200 мкг/кг протягом 7 днів призводила до атрезії фолікулярних клітин, набряку та гіперплазії клітин яйцепроводу та матки. Автори відзначили, що корм для тварин може містити 5,0-299,5 мкг/кг зеараленону. Інша стаття цих дослідників повідомила, що в собак, які отримували до 50 мкг/кг протягом 100 днів, наступала залежна від дози дегенерація гранульозних клітин.
Годування індиків їжею з Fusarium несприятливо впливало на продукцію яєць, але чистий зеараленон впливав не так драматично. Автори дійшли висновку, що інші сполуки, які забруднюють, їжу можуть відповідати за репродуктивну токсичність. Курчата є стійкими до токсичних репродуктивних наслідків зеараленону.
Поведінкове дослідження у щурів з оваріектомією виявило, що зеараленон в дозі 1 та 2 мг (але не 0,2 мг) підвищував концентрацію нейрональних прогестинових рецепторів. Доза 2 мг підвищувала щільність фарбування прогестеронових рецепторів в порівнянні з 10 мкг естрадіолу бензоату; 2 мг зеараленону еквівалентні естрадіолу в індукції сексуальної сприйнятливості після лікування прогестероном.
Інформація щодо впливу на плід:
Відсутні репродуктивні дослідження у людини.
Абстракт статті на китайській мові пов’язав споживання зерна, забрудненого Fusarium з «ендемічною хворобою збільшення грудних залоз» в Китаї.
Застосування препарату під час вигодовування:
Зеараленон виявляється в молоці корів разом з його кон’югатами та зеараленолом (естрогеновий метаболіт) після високої пероральної дози.
Відсутня інформація про вплив зеараленону при грудному вигодовуванні у людини.
Вплив на фертильність (чоловіків та жінок):
У чоловічої статі.
Невелику групу кабанів годували 0,2 або 1,0 ppm зеараленону без несприятливого впливу на лібідо або якість сперми. Інше дослідження не виявило негативного впливу на показники сперми при дозах до 200 ppm з дієтою. У самців щурів доза 0,25 мг/кг, введена шляхом гастральної інтубації, знижувала споживання їжі та вагу тіла, концентрацію тестостерону в сироватці, кількість сперматозоїдів в хвості придатку яєчка та вагу репродуктивних органів. Інше дослідження виявило, що висока доза зеараленону протягом 5 тижнів істотно підвищувала концентрацію пролактину в сироватці, інших змін не виявляли. Введення самцям мишей інтраперитонеально 25 мг/кг/день протягом 7 днів негативно впливало на сперматозоїди, а після парування з нелікованими самками підвищувався рівень резорбції. Введення мишам через зонд дози 40 мг/кг (8% LD50; середня летальна доза, median lethal dose, “lethal dose, 50%”) призводило до істотного зниження тестостерону. Самців фазанів годували забрудненою мікотоксином їжею, в результаті чого розвинулась атрофія яєчок з особливим впливом на гермінальний епітелій, яйця у самок після парування були неплідними.
Введення самцям щурів зеараленону з питною водою в дозі 0,15 мкг/л зменшувало концентрацію сперми, підвищувало кількість морфологічно аномальних сперматозоїдів та підвищувало зв’язування апоптичного маркеру аннексину V. Також спостерігали зміни генів, відповідальних за сперматогенез. Автори наголошують на сильнішому ефекті цієї дози в порівнянні з вищою дозою 150 мкг/л (з питною водою).
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
ЕДРОФОНІЙ
Група/призначення:
Парасимпатоміметик, холінергічний засіб.
Альтернативні назви / синоніми: тенсілон, енлон.
Діюча речовина: едрофоній.
Рекомендації при вагітності:
Припускається ризик в ІІІ триместрі.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Це четвертинна сполука амонію з антихолінестеразною активністю, яку використовують для діагностики міастенія гравіс* без підвищення частоти вроджених вад розвитку.
|
*Міастенія гравіс (myasthenia gravis) – аутоімунне захворювання, яке викликає прогресуючу слабкість м’язів в результаті порушення нервово-м’язової передачі. У більшості випадків страждають м’язи очей, жувальні і лицьові, рідше – дихальні. Частіше хворіють жінки у віці. |
Інформація щодо досліджень на тваринах:
Відсутня. Препарати цього класу пов’язують з порушеннями опорно-рухового апарату ембріонів курчат. Це пояснюється важливою роллю ацетилхоліну в ембріональному розвитку.
Інформація щодо впливу на плід:
Досвід застосування обмежений.
Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до ембріону/плода.
Деякі автори висловлюють стурбованість щодо внутрішньовенного введення антихолінестераз через можливість індукції передчасних пологів.
Цей вплив на вагітну матку зростає перед пологами. Рекомендується введення неостигміну внутрішньом’язово як альтернатива внутрішньовенному едрофонію, якщо цього вимагає захворювання вагітної. Однак, потенційними ускладненнями внутрішньому’язово введеного неостигміну є вагінальні кровотечі та аборти. Повідомляється про внутрішньовенне введення едрофонію жінці в ІІ триместрі в невдалій спробі лікування тахікардії, вторинної до синдрому Вольфа-Паркінсона-Уайта. Не спостерігали впливу на матку, вагітність була доношена.
Транзиторна м’язова слабкість спостерігається у 20% новонароджених від матерів з міастенія гравіс. Неонатальну міастенію викликає трансплацентарний пасаж антитіл IgG до ацетилхолінових рецепторів.
Застосування препарату під час вигодовування:
Відсутня інформація. Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до грудного молока. Вплив такої кількості препарату на немовля невідомий, якщо взагалі існує.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
АМБЕНОНІЙ
Група/призначення:
Парасимпатоміметик, холінергічний засіб.
Альтернативні назви / синоніми:
Оксазил, амбенонію хлорид.
Діюча речовина: амбеноній.
Рекомендації при вагітності:
Обмежені дані; відсутні дані від експериментальних тварин.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Досвід застосування у людини при вагітності дуже обмежений і недостатній для оцінки ембріо-фетального ризику. Відсутні дані від експериментальних тварин.
Це четвертинна сполука амонію, яку використовують для діагностики та лікування міастенія гравіс*.
|
*Міастенія гравіс (myasthenia gravis) – аутоімунне захворювання, яке викликає прогресуючу слабкість м’язів в результаті порушення нервово-м’язової передачі. У більшості випадків страждають м’язи очей, жувальні і лицьові, рідше – дихальні. Частіше хворіють жінки у віці. |
Інформація щодо досліджень на тваринах:
Відсутня. Препарати цього класу пов’язують з порушеннями опорно-рухового апарату ембріонів курчат. Це пояснюється важливою роллю ацетилхоліну в ембріональному розвитку.
Інформація щодо впливу на плід:
Досвід застосування обмежений.
Повідомляється про випадок прийому жінкою амбенонію (60 мг/день), піридостигміну (420 мг/день), неостигміну (105 мг/день) протягом вагітності без шкоди для плода.
Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до ембріону/плода.
Деякі автори висловлюють стурбованість щодо внутрішньовенного введення антихолінестераз через можливість індукції передчасних пологів.
Транзиторна м’язова слабкість спостерігається у 20% новонароджених від матерів з міастенія гравіс. Неонатальну міастенію викликає трансплацентарний пасаж антитіл IgG до ацетилхолінових рецепторів.
Застосування препарату під час вигодовування:
Відсутня інформація. Хоча препарат іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до грудного молока. Проте кількість препарату в грудному молоці є, очевидно, малою. Вплив такої кількості на немовля невідомий, якщо взагалі існує.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 02.07.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 03.07.2018 р.
СУГАМАДЕКС
Група/призначення:
Антидот, селективний антагоніст рокуронію та векуронію.
Покази: реверсія нейром’язової блокади, спричиненої рокуронієм або верокуронієм.
Альтернативні назви / синоніми: брайдан.
Діюча речовина: сугамадекс.
Рекомендації при вагітності:
Відсутні дані; дані від експериментальних тварин припускають низький ризик.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Не призводить до вроджених вад розвитку у щурів та кролів.
Інформація щодо досліджень на тваринах:
Згідно з інструкцією до препарату не спостерігали підвищення частоти вроджених вад розвитку після внутрішньовенного введення щурам та кролям на 6-17 дні вагітності в дозах, які у 6-8 раз перевищують максимальну рекомендовану для людини, виходячи з AUC*.
|
*AUC – фармакокінетичний параметр, який характеризує сумарну концентрацію лікарського препарату в плазмі крові протягом всього часу спостереження; це абревіатура від англ. Area Under the Curve (площа під кривою). |
У кролів спостерігали зменшення ваги плодів та затримку осифікації на фоні материнської токсичності при 8-кратній від максимальної рекомендованої для людини дозі. Зниження ваги плодів кролів відзначали і на фоні подвійної максимальної рекомендованої дози для людини, при якій не відзначали токсичного впливу на матір.
Повідомлення 2015 року інформує про введення сугамадексу вагітним щурам в дозі 30 мг/кг внутрішньовенно з або без 3,5 мг/кг рокуронію на 7 гестаційний день. Це не впливало на концентрацію прогестерону. Вагітності протікали нормально, без самовільного переривання та мертвонароджень. Потомство макроскопічно виглядало нормальним.
Інформація щодо впливу на плід:
Відсутній досвід застосування.
У 2016 році повідомили про успішне використання сугамадексу в якості зворотнього агенту для неостигміну у вагітної з синдромом Вольфа-Паркінсона-Уайта (це синдром передчасного збудження шлуночків по додатковому (аномальному) шляху проведення імпульсів, а також виникненням надшлуночкових тахіаритмій по типу re-entry).
Застосування препарату під час вигодовування:
Згідно з інструкцією до препарату він проникає до молока щурів. Вплив на щуренят з молоком не призводив до несприятливого впливу на вагу, фізичний розвиток та поведінку.
Вплив на фертильність (чоловіків та жінок):
Згідно з інструкцією сугамадекс знижує ефективність оральних контрацептивів шляхом пониження концентрації гормонів в сироватці. При введенні самцям щурів внутрішньовенно 6-кратних максимальній рекомендованій для людини доз протягом 29 днів перед та протягом парування, а самкам – протягом 14 днів до парування та ще 5 днів після не спостерігали несприятливих наслідків.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
Адаптовано 26.06.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 27.06.2018 р.
РОКУРОНІЙ
Група/призначення:
Міорелаксант з периферичним механізмом дії, курареподібний (див. статтю Кураре).
Рокуроній (рокуронію бромід) – швидкодіючий, середньої тривалості дії, недеполяризуючий міорелаксант, що має всі фармакологічні ефекти, характерні для цього класу препаратів (курареподібних). Він блокує нікотинові холінорецептори кінцевої пластинки рухового нерва скелетного м’яза. Антагоністами цієї дії є інгібітори ацетилхолінестерази, наприклад неостигмін, ендорфоній і піридостигмін.
Структурно це четвертинна сполука амонію, аналог векуронію.
Альтернативні назви / синоніми:
Есмерон, земурон, рокуронію бромід.
Діюча речовина: рокуронію бромід.
Рекомендації при вагітності:
Обмежені дані; дані від експериментальних тварин припускають низький ризик.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Досвід застосування при вагітності у людини обмежений ІІ та ІІІ триместрами. Хоча відсутня інформація про вплив в період органогенезу, в цілому нейром’язові блокатори не представляють істотного ризику для ембріону чи плода. Дані від експериментальних тварин припускають низький ризик. Окрім того, сполука містить четвертинний амоній, що обмежує плацентарний трансфер. Одне рев’ю передбачає, що концентрація препарату в матері завжди буде перевищувати показник у плода. Нейром’язова блокада у новонародженого є рідкісним, але потенційним ускладненням. При потребі введення рокуронію його не слід відміняти через вагітність.
Інформація щодо досліджень на тваринах:
Репродуктивні дослідження проводились у щурів та кролів. В цих видів тварин максимальна толерантна внутрішньовенна доза, призначена тричі на день в період органогенезу не була тератогенною. Ці дози становили 15-30% та 25%, відповідно, від рекомендованої інтубаційної дози для людини (0,6-1,2 мг/кг), виходячи з площі поверхні тіла. У щурів частота загибелі плодів підвищувалась, як вважається, внаслідок кисневого дефіциту в результаті гострих симптомів респіраторної дисфункції у самок.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Призначається внутрішньовенно перед загальною анестезією для релаксації скелетних м’язів. В здорових дорослих період напіввиведення становить приблизно 2,4 години, біля 30% зв’язується з білками плазми.
Виходячи з молекулярної ваги, обмеженого плацентарного трансферу невелика кількість рокуронію проникає через плаценту до плода (18% від материнської).
В 32 пацієнток з дослідження, яке наводиться нижче, середні рівні у венозній крові матері та венозній крові пуповини становили 2412 нг/мл та 390 нг/мл, відповідно, а співвідношення концентрації в пуповині до материнської крові – 0,16. У 12 пацієнток середня концентрація препарату в пупковій артерії становила близько 271 нг/мл, що дало співвідношення пупкова артерія : пупкова вена 0,62.
Проспективне нерандомізоване мультицентрове дослідження 1994 року охопило 40 жінок з плановим кесаревим розтином. Вони отримали індукцію анестезії рокуронієм та тіопенталом, а далі – ізофлуран та закис азоту для підтримки. Не виявлено несприятливих наслідків впливу рокуронію.
Повідомлення 1996 року інформує про введення рекуронію 31-річній жінці на 28 тижні вагітності з проникаючою травмою ока внаслідок дорожньо-транспортної події. Перед індукцією анестезії почали внутрішньовенну інфузію магнезії сульфату для лікування скорочень матки, які проявились в цей час. Анестезію розпочали з рокуронію (0,9 мг/кг), фентанілу (200 μ/г) та тіопенталу натрію (400 мг). Частоту серцевих скорочень (140-150 ударів на хвилину) моніторували протягом 6 годин хірургічного втручання. За винятком зниження короткотривалої варіабельності внаслідок анестезії у плода, не виявляли іншого впливу на частоту серцевих скорочень плода. Хоча автори усвідомлювали взаємодію з магнезії сульфатом, вони вибрали вищу дозу (звичайна доза 0,6 мг/кг), що дозволило забезпечити більш швидку інтубацію. Як і очікувалось, тривалість паралічу була подовжена, вторинно до високої дози та взаємодії з магнезією, але автори вважають, що це було прийнятним, виходячи із стану вагітної. Жінку виписали з лікарні через 6 днів після хірургічного втручання з нормально прогресуючою вагітністю. Результат вагітності невідомий.
Рекуроній призначали 35-річній жінці перед комбінованим втручанням: кесаревим розтином та краніотомією задньої черепної ямки на 37 тижні вагітності. У жінки синдром Гіппеля-Ландау, а хірургічне втручання було необхідним через гемангіобластому, яка збільшувалась. Загальну анестезію індукували рокуронієм (50 мг), фентанілом (200 мкг), тіопенталом (300 мг). Оцінка за шкалою Апгар новонародженого хлопчика становила 5, 7 та 9 балів на 1-й, 5-й та 10-й хвилинах, відповідно. Була необхідність введення налоксону через слабкі дихальні рухи на 2-й хвилині життя.
Дослідження 1997 року порівнювало вплив тіопенталу/рокуронію з кетаміном/рокуронієм (по 20 жінок в кожній групі) для швидкої послідовної інтубації при кесаревому розтині. Автори дійшли висновку про прийнятність обох комбінацій препаратів. Виходячи з оцінки за шкалою Апгар на 1-й та 5-й хвилинах, не виявлено істотної різниці в стані новонароджених між двома групами.
Застосування препарату під час вигодовування:
Відсутня інформація. Виходячи з показів до застосування препарату, малоймовірно, що повідомлення про застосування в період лактації з’являться. Молекулярна вага припускає проникнення до грудного молока, але кількість буде обмежена за рахунок іонізації препарату при фізіологічному рН. Вплив на немовля невідомий, але, як здається, клінічно незначимий.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 26.06.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 27.06.2018 р.
ПІРИДОСТИГМІН
Група/призначення: парасимпатоміметик, холінергетик.
Альтернативні назви / синоніми:
Калімін, піридостигміну бромід, местинон.
Діюча речовина: піридостигмін.
Рекомендації при вагітності:
Обмежені дані; дані від експериментальних тварин припускають низький ризик.
Рекомендації при лактації:
Обмежена інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Це четвертинна сполука амонію, яку використовують для діагностики та лікування міастенії гравіс* та для зняття м’язової релаксації внаслідок дії недеполяризуючих міорелаксантів. Більшість дослідження повідомляють про використання з такою ціллю без шкоди для ембріону/плода, дані від експериментальних тварин припускають низький ризик.
|
*Міастенія гравіс (myasthenia gravis) – аутоімунне захворювання, яке викликає прогресуючу слабкість м’язів в результаті порушення нервово-м’язової передачі. У більшості випадків страждають м’язи очей, жувальні і лицьові, рідше – дихальні. Частіше хворіють жінки у віці. |
Інформація щодо досліджень на тваринах:
Піридостигмін не був тератогенним у щурів при дозах до 30 мг/кг/день, але при вищих дозах з’являлась материнська та фетальна токсичність (зменшення ваги).
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Хоча піридостигмін іонізується при фізіологічному рН, молекулярна вага є відносно низькою, що припускає трансфер неіонізованої фракції до ембріону/плоду.
Концентрація піридостигміну визначалась при народженні в материнській плазмі, пуповині, амніотичній рідині. Двох жінок з тривалою міастенія гравіс в анамнезі лікували протягом вагітності піридостигміном, 360 мг та 420 мг в день, відповідно. Остання жінка також отримувала неостигмін (105 мг/день) та амбеноній (60 мг/день). В першому випадку концентрація препарату в плазмі, пуповині, амніотичній рідині становила 77, 65 та 290 нг/мл, відповідно, а в другої – 53, 39 та 300 нг/мл, відповідно. Таким чином, співвідношення пуповина : плазма матері становило 0,84 та 0,74, відповідно, в той час як амніотична рідина : материснька плазма – 3,8 та 5,7, відповідно.
Висловлюється стурбованість щодо використання при вагітності внутрішньовенно антихолінестераз через ймовірність передчасних пологів. Цей ефект на вагітну матку зростає перед пологами.
Кілька повідомлень описують безпечне використання піридостигміну при вагітності. Однак, опубліковане у 2000 році інформує про мікроцефалію та ураження центральної нервової системи у новонародженого внаслідок впливу високих доз піридостигміну. Мати була 24-річною першовагітною з 14-річним анамнезом міастенія гравіс. ЇЇ стан потребував високих дох піридостигміну (1500-3000 мг/день) протягом вагітності для контролю диплопії та птозу. Для порівняння, середня рекомендована добова доза становить 600 мг, у важких випадках – ≤1500 мг. На 36 тижні призначено ургентний кесаревий розтин через брадикардію плода, народився хлопчик з вираженою затримкою внутрішньоутробного розвитку, гіпотонією, оцінкою за шкалою Апгар 3 та 8 балів на 1-й та 5-й хвилинах, відповідно. Невдовзі після народження діагностували міастенію гравіс, проведено два обмінні переливання крові для зниження титру антитіл до рецепторів ацетилхоліну, призначено внутрішньовенно імуноглобулін. Немовля потребувало негайної інтубації через слабке дихання, яке продовжувалось до віку 3,5 місяців. При народженні діагностували помірну контрактуру пальців та зап’ястку. Окружність голови становила 33,5 см при народженні та 37 см (<5 перцентилю) у віці 3 місяців. У віці 5 місяців відзначили ряд дизморій, включно з широкою основою виступаючого носа, легким антимонголоїдним розрізом очей, високим піднебінням, короткою шиєю, широкою грудною клітиною, камптодактилією (згинальна контрактура пальців кисті), молоткоподібними пальцями стоп. Дитина не одужувала, потребувала додаткових госпіталізацій та механічної вентиляції. У віці 4,5 місяців немовля виписали додому, але через тиждень знову госпіталізували через тривалі апное та ціаноз. Вага (5,1 кг, 10-й перцентиль) та окружність голови (38 см, <2 перцентиля) все ще були затриманими, залишалась гіпотонія. Нейросонографія, каріотип, титри ТОРЧ-інфекцій були нормальними або негативними, не було ознак краніосиностозу. МРТ головного мозку у віці 5 місяців виявило брахіцефалію і помірну вентрикуломегалію. У віці 9 місяців дитина все ще потребувала назальної оксигенації, м‘язовий тонус був нормальним, контрактури суглобів пройшли, рефлекси були жвавими, присутній гомілковостопний клонус. Оскільки не було виявлено жодних інших причин, автори віднесли мікроцефалію та ураження центральної нервової системи до впливу піридостигміну.
Спільний перинатальний проект (Collaborative Perinatal Project) також не виявив несприятливих результатів вагітностей, асоційованих з лікуванням піридостигміном. Повідомлення з ранніх 1980- описало 12 вагітностей у 8 жінок з міастенією та дійшло висновку, що тимектомія перед вагітністю є найкращим методом лікування. Однак, цей висновок базується на легкому контролі та попередженні загострення міастенії радше, ніж несприятливих наслідках терапії піридостинміном.
Повідомляється як про антенатальну, так і про постнатальну міастенія гравіс, обидві можуть призводити до перинатальної загибелі. Обидві форми розладу спричиняються трансплацентарним пасажем імуноглобуліну G антитіл до ацетилхолінових рецепторів. Пригнічення рухів скелетних м’язів плода може призводити до гіпоплазії легень, множинного артрогрипозу, полігідрамніону.
Транзиторна м’язова слабкість спостерігається у 20% новонароджених від матерів з міастенія гравіс. Неонатальну міастенію викликає трансплацентарний пасаж антитіл IgG до анти-ацетилхолінових рецепторів.
Застосування препарату під час вигодовування:
Піридостигмін проникає до грудного молока. Рівень у двох жінок, які отримували 120-300 мг/день становив 2-25 нг/мл, представляючи співвідношення молоко : плазма 0,36-1,13. Хоча піридостигмін є іонізованою четвертинною сполукою, ці величини свідчать про легке проникнення до молока неіонізованої фракції. У дітей препарат не визначався, як і жодні несприятливі наслідки. Автори підрахували, що два немовлята отримали ≤0,1% материнської дози.
Американська академія педіатрії вважає піридостигмін сумісним з грудним вигодовуванням.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.
Адаптовано 26.06.2018 р.:
Е.Й. Пацкун, лікар-генетик, кандидат медичних наук, доцент кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету.
Переглянуто редакційною колегією 27.06.2018 р.
ПАНКУРОНІЙ
Група/призначення:
Недеполяризуючий нейром’язовий блокатор, курареподібний (див. статтю Кураре).
Покази: міорелаксація при проведенні різного роду оперативних втручань, включно з кесаревим розтином, та інвазивних втручань у плодів, з використанням ШВЛ.
Альтернативні назви / синоніми:
Панкуронію бромід, павулон.
Діюча речовина: панкуронію бромід.
Рекомендації при вагітності:
Обмежені дані; дані від експериментальних тварин припускають низький ризик.
Рекомендації при лактації:
Відсутня інформація; ймовірно сумісний.
Прийом під час вагітності (короткий висновок):
Панкуроній призначають безпосередньо плодам наприкінці вагітності при потребі в інвазивних процедурах (для обмеження рухів плода під час процедури) та матерям в кесаревому розтині – без описаних несприятливих наслідків. Хоча в двох видів тварин не спостерігали тератогенності, не повідомляється про застосування панкуронію на ранніх термінах вагітності у людини. Відомо, що препарат проникає через плаценту у людини, принаймні, перед пологами. Великі або повторні дози та/або тривале введення до пологів потенційно може призвести до пригнічення новонародженого, але клінічне значення цього здається низьким. Більше того, інші анестетики можуть вплинути на стан немовляти. Окрім того, транзиторні зміни частоти серцевих скорочень, такі як зниження акселерації, варіабельності та випадковий синусоподібний паттерн спостерігали після безпосереднього введення плода, але це не несло загрози для плода.
Інформація щодо досліджень на тваринах:
Неопубліковані репродуктивні дослідження у щурів та кролів з панкуронієм не виявили жодного впливу на рівень резорбції, вагу та розмір плодів, їх виживання чи частоту вроджених вад розвитку (великих, скелетних, внутрішніх органів). Вагітним щурам (середня тривалість гестації 21-22 дні) вводили внутрішньобрюшинно дозу 0,16 мг/кг/день або з 7 до 14 дня, або з 1 до 20, а вагітним кролям (середня тривалість гестації 31-34 дні) – внутрішньовенно 0,02 мг/кг/день з 8 до 16 днів вагітності.
При впливі панкуронію на культуру ембріонів щурів виникала затримка розвитку тільки на фоні трикратної клінічної дози. Оскільки пренатальні рухи є важливими для розвитку нормальних суглобів, тривалий вплив цього або інших подібних препаратів, які іммобілізують, плід негативно відобразиться саме на цьому процесі. Таку можливість вивчали детально у щурів з використанням кураре. Підвищення частоти контрактур, затримки розвитку, короткої пуповини асоціювалось з таким впливом.
Інформація щодо впливу на плід:
Наводимо дані різних досліджень.
Теоретично, відносно висока молекулярна вага та наявність двох четвертинних амонієвих груп, які іонізуються в фізіологічному рН, повинні обмежити плацентарний трансфер панкуронію. Дослідження у тварин у 1973 році підтвердило відсутність істотного трансферу. Так, призначення кумулятивних внутрішньовенних доз до 16,3 мг/кг вагітним тхорам (нейром’язовий блок у матерів наступав при дозі 0,015 мг/кг) не призводив до нейром’язової блокади плодів при спостереженні протягом години. Плоди були чутливими до індукованої панкуронієм блокади при прямому введенні. Надалі відсутність несприятливих наслідків у новонароджених після середньої дози 0,0875 мг/кг в кесаревому розтині спонукала деяких авторів дійти висновку про відсутність проникнення препарату через плаценту. Однак, кілька досліджень у людини продемонстрували плацентарний трансфер, принаймні, перед пологами, при застосуванні в кесаревому розтині. Концентрація препарату в пуповині становить 11-19% від материнського показника.
Материнські внутрішньовенні болюсні* дози в межах 0,04-0,12 мг/кг (приблизно 2,8-8,6-кратна материнській ED50** – дозі, що викликає пригнічення викликаної напруги в 50%) призводили до середнього співвідношення пупкова вена : венозна кров матері 0,19-0,26. Це співвідношення було вищим за визначене для атракурію, фазадинію, піпекуронію, рокуронію, d-тубокурарину (кураре), векуронію. Не виявлено клінічних доказів нейром’язової блокади в 5 дослідженнях, які оцінювали стан новонароджених. Але в одному дослідженні неврологічні та адаптаційні показники (Neurological and adaptivecapacity scores, NACS) продемонстрували пригнічення при визначенні на 15-й хвилині, 2-й та 24-й годинах у 7 новонароджених, чиї матері отримали внутрішньовенно d-тубокурарин (3 мг), тіопентал (4 мг/кг), сукцинілхолін (1,5 мг/кг), панкуроній (0,04 мг/кг) безпосередньо перед кесаревим розтином. В 5 новонароджених (71%) NACS становив <35 на 15 хвилині, в трьох <35 на 2 годині і в жодного <35 на 24 годині (норма 35-40). Хоча показники NACS свідчили про пригнічення, не спостерігали несприятливих наслідків у новонароджених. Рев’ю 1998 року, коментуючи ці та інші дослідження щодо використання нейром’язових релаксантів при вагітності, вважає, що низькі показники NACS можуть бути спричиненими вкладом інших анестетиків.
|
*Болюс – відносно великий об’єм рідини або дози препарату, що вводиться внутрішньовенно і швидко викликає відповідну реакцію. **Ефективна доза (ЕД) в фармакології – це кількість або доза лікарського засобу, яка забезпечує терапевтичну відповідь або бажаний ефект в певної кількості людей, які її приймають. ED50 – середня ефективна доза “median effective dose” – доза, що спричиняє квантовий ефект (все або нічого) у 50% популяції, яка її приймає. |
Пряме/безпосереднє введення панкуронію [плода]описане у тварин та людини. Повідомлення 1989 року порівняло вплив панкуронію (0,5 мг/кг внутрішньовенно понад 5 хвилин) та d-тубокурарину (3,0 мг/кг внутрішньовенно понад 5 хвилин) на частоту серцевих скорочень та середній артеріальний тиск у плодів баранів. В той час як панкуроній істотно підвищував як частоту скорочень, так і тиск, d-тубокурарин істотно знижував обидва показники. Тільки панкуроній впливав на рН та РСО2 плода, підвищуючи перший і знижуючи другий показник. Дослідження у людини, описані нижче, стосуються призначення панкуронію в другій половині вагітності.
Дослідження 1988 року оцінювало базову частоту серцевих скорочень, число акселерацій, варіабельність до та після внутрішньовенного болюсу панкуронію (0,05-0,10 мг/кг) 17 плодам перед трансфузією. Через 20 хвилин після трансфузії не відзначали змін базової частоти скорочень, хоча з’явились деякі паттерни («синусоїдо-подібні»), але виявлено істотне зниження акселерацій (р=0,003) та варіабельності (р=0,0003). Транзиторні зміни частоти серцевих скорочень не свідчили про пошкодження плода, показники нормалізувались, коли плід «прокидався».
Повідомлення 1991 року інформує про значно меншу брадикардію при використанні панкуронію (0,3 мг/кг) в порівнянні зі станом без використання міорелаксантів після кордоцентезу (3,6% [8/224] проти 8,2% [27/329], р=0,04) та після інтраваскулярної трансфузії (7,9% [9/114] проти 40% [2/5], p=0,06).
Панкуроній (0,1 мг/кг внутрішньовенно) призначали 20 плодам безпосередньо перед гемотрансфузією на 28-34 тижнях вагітності. Порівняння проводили з контрольною групою (N=20) з аналогічними показниками (гестаційний вік, гематокрит). Після трансфузії у плодів з групи панкуронію підвищення серцевого ритму спостерігалось рідше (0 проти 3,0 в контрольній групі, р <0,0005), було менше змін базового ритму (збільшення на 1,5 ударів на хвилину проти зменшення на 4 удари на хвилину в контрольній групі, р<0,0005), нижче від середнього коливання варіабельності серцевого ритму за хвилину (17,3 проти 34,7, р<0,0001), менша кількість короткочасної варіабельності (3,4 проти 7,35, р=0,0001). Інше дослідження порівнювало зміни частоти серцевого ритму після використання панкуронію або векуронію для інтраваскулярної трансфузії, торацентезу або парацентезу у плода. Автори дійшли висновку, що індуковане панкуронієм збільшення частоти серцевих скорочень та зниження варіабельності робить його менш бажаним, ніж векуроній, який не викликає таких змін.
Повідомляється про випадок загибелі плоду на 25,5 тижні вагітності в результаті гематоми пуповини, яка утворилась через 2 години після інтраваскулярної внутрішньоматкової інфузії. На думку авторів, це пов’язано з введенням панкуронію до підтвердження проникнення голки аспірацією крові плода. Аутопсія підтвердила, що причиною смерті була компресія пупкової вени гематомою з наступним венозним тромбозом пуповини.
Ряд публікацій описали введення панкуронію безпосередньо перед магнітно-резонансним обстеженням. Найчастіше застосовували дози 0,08-0,3 мг/кг (внутрішньовенно у вену пуповини або внутрішньом’язово), в двох випадках – 0,5 мг внутрішньом’язово, в одному – 100 мг у внутрішньопечінкові вени обох близнюків.
В інших двох випадках вводили панкуроній (0,15 мг/кг, виходячи з загальної ваги обох плодів при двійні) меншому з двох плодів. Процедуру проводили як спробу діагностики фето-фетального трансфузійного синдрому. В першому випадку паттерн частоти серцевих скорочень обох близнюків демонстрував відсутність акселерацій та зниження варіабельності, окрім того, більший плід мав «синусоїдо-подібний» паттерн. В другому випадку відсутність акселерацій та зниження варіабельності спостерігали тільки у меншого плода.
Повідомляється про тривалу інфузію морфіну, мідазоламу, панкуронію протягом 10 годин для забезпечення механічної вентиляції важкохворій вагітній приблизно на 35 тижні – пневмонія, викликана Legionella pneumophila. Під час інфузії не відзначали негативного впливу на плід, але він постійно «спав». Приблизно через 3-4 тижні народилась здорова дівчинка.
Призначення солей магнію для лікування токсикозу вагітних може посилити нером’язову блокаду, викликану панкуронієм.
Застосування препарату під час вигодовування:
Відсутня інформація. Виходячи з показів до застосування препарату, малоймовірно, що повідомлення про застосування в період лактації з’являться. Препарат іонізується при фізіологічному рН. До грудного молока може проникнути тільки неіонізована форма, а це тільки слідові концентрації. Окрім того, подібні сполуки слабо абсорбуються в шлунково–кишковому тракті.
Вплив на фертильність (чоловіків та жінок): відсутня інформація.
Адаптовано за матеріалами:
- Інформаційна система Центру репродуктивної токсикології “Reprotox” (http://www.reprotox.org).
- Briggs G, Freeman R, Yaffe S. Drugs in Pregnancy and Lactation: a Reference Guide to Fetal and Neonatal Risk. Ninth edition, 2011, Wolters Kluwer, Lippincott Williams & Wilkins. 1728 pages. ISBN: 978-1-60831-708-0.